题目内容
10.如图图示与对应的叙述相符的是( )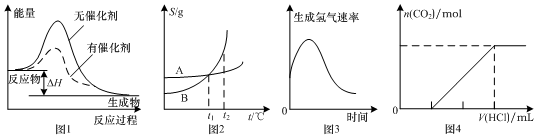
| A. | 图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| C. | 图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应 | |
| D. | 图4表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1 mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |
分析 A.加入催化剂,可降低反应的活化能;
B.t1℃时A、B的饱和溶液质量分数相等,升高温度,溶解度增大,但质量分数不变;
C.根据温度和浓度对速率的影响分析;
D.碳酸钠先和盐酸反应生成碳酸氢钠,如分别为NaOH、Na2CO31mol,则生成气体时消耗2molHCl,最后生成1mol二氧化碳.
解答 解:A.加入催化剂,可降低反应的活化能,图象符合,故A正确;
B.t1℃时A、B的饱和溶液质量分数相等,升高温度,溶解度增大,但质量分数不变,则溶质的质量分数B=A,故B错误;
C.开始时反应放热温度升高,则反应速率加快,随着反应进行浓度减小,则速率减小,故C正确;
D.碳酸钠先和盐酸反应生成碳酸氢钠,如分别为NaOH、Na2CO31mol,则生成气体时消耗2molHCl,最后生成1mol二氧化碳,则图象中生成二氧化碳前后消耗的盐酸体积比为2:1,故D错误.
故选AC.
点评 本题考查较为综合,为高考常见题型,侧重考查学生的分析能力,注意把握图象中曲线变化的特点,难度中等,易错点为D,注意把握物质的性质以及反应的特点.

练习册系列答案
相关题目
1.近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染.
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ/mol.
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200kJ•mol-1
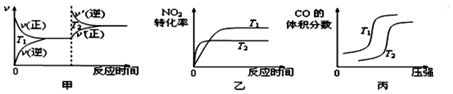
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).
(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如表:
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(NO)=0.030mol•L-1•min-1;计算该反应的平衡常数K=0.56.
②30min后,只改变某一条件,根据表的数据判断改变的条件可能是CD(填字母代号).
A.通入一定量的CO2 B.加入合适的催化剂
C.适当缩小容器的体积 D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率降低(填“升高”或“降低”),a<0(填“>”或“<”).
(4)温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入1L的密闭容器中发生反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H=bkJ/mol.测得有关数据如表:
下列说法正确的是CD
A.T1>T2,且b>0
B.当温度为T2、反应进行到40min时,x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50mol CH4和1.2mol NO2,重新达到平衡时,n(N2)<0.70mol
D.温度为T1时,若起始时向容器中充入0.50mol CH4(g)、0.50molNO2(g)、1.0mol N2(g)、2.0molCO2(g)、0.50molH2O(g),反应开始时,ν(正)>ν(逆)
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染.
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ/mol.
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200kJ•mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).

(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如表:
| 时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.3 0 | 0.36 | 0.36 |
②30min后,只改变某一条件,根据表的数据判断改变的条件可能是CD(填字母代号).
A.通入一定量的CO2 B.加入合适的催化剂
C.适当缩小容器的体积 D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率降低(填“升高”或“降低”),a<0(填“>”或“<”).
(4)温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入1L的密闭容器中发生反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H=bkJ/mol.测得有关数据如表:
| 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
A.T1>T2,且b>0
B.当温度为T2、反应进行到40min时,x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50mol CH4和1.2mol NO2,重新达到平衡时,n(N2)<0.70mol
D.温度为T1时,若起始时向容器中充入0.50mol CH4(g)、0.50molNO2(g)、1.0mol N2(g)、2.0molCO2(g)、0.50molH2O(g),反应开始时,ν(正)>ν(逆)
5.下列物质的转化在给定条件下能实现的是( )
| A. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| B. | MgO$\stackrel{H_{2}SO_{4}}{→}$MgSO4(aq)$\stackrel{电解}{→}$Mg | |
| C. | 饱和NaCl(aq)$\underset{\stackrel{①N{H}_{3}}{→}}{②C{O}_{2}}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | NH3$→_{催化剂,△}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 |
2.下列说法不正确的是( )
| A. | 蛋白质水解的最终产物是氨基酸 | |
| B. | 油脂水解生成甘油和高级脂肪酸或高级脂肪酸盐 | |
| C. | 淀粉水解的最终产物是葡萄糖 | |
| D. | 重油裂解可以得到汽油 |
19.有常温下物质的量浓度均为0.1mo/L的①氨水②NH4Cl溶液③Na2CO3溶液④NaHCO3溶液,下列说法正确的是( )
| A. | 4种溶液pH的大小顺序:①>④>③>② | |
| B. | 等体积的①和②溶液混合后pH>7,c(NH3•H2O)>c( NH4+) | |
| C. | 溶液①、③由水电离产生的c(OH-):①<③ | |
| D. | 溶液③、④等体积混合后,溶液中c(CO32-)>c(HCO3-) |
12.碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
(1)海带中富含碘,请简述检验碘的实验方案取海带灼烧成灰,加水浸取后过滤,向滤液中加入硫酸与双氧水,再加淀粉试液变蓝,说明含有碘;
(2)已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436KJ、299KJ的能量,则1molI2(g)分子中化学键断裂时需吸收的能量为151kJ;
(3)Bodensteins研究了下列反应:2HI(g)═H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
①根据上述实验结果,该反应的平衡常数K的计算式为:$\frac{0.10{8}^{2}}{0.78{4}^{2}}$;(不用求出结果)
②其他条件不变,向平衡后体系中再加入少量HI,则平衡向正(填“正”或“逆”)反应方向移动,达到平衡后x(HI)不变(填“增大”、“减小”或“不变”).
③上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{K}_{正}}{K}$(以K和K正表示);若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1min-1.
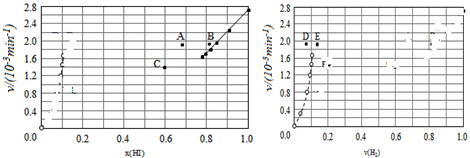
④由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为A、E(填字母).
(1)海带中富含碘,请简述检验碘的实验方案取海带灼烧成灰,加水浸取后过滤,向滤液中加入硫酸与双氧水,再加淀粉试液变蓝,说明含有碘;
(2)已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436KJ、299KJ的能量,则1molI2(g)分子中化学键断裂时需吸收的能量为151kJ;
(3)Bodensteins研究了下列反应:2HI(g)═H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②其他条件不变,向平衡后体系中再加入少量HI,则平衡向正(填“正”或“逆”)反应方向移动,达到平衡后x(HI)不变(填“增大”、“减小”或“不变”).
③上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{K}_{正}}{K}$(以K和K正表示);若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1min-1.
④由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为A、E(填字母).





 .
.