题目内容
19.有常温下物质的量浓度均为0.1mo/L的①氨水②NH4Cl溶液③Na2CO3溶液④NaHCO3溶液,下列说法正确的是( )| A. | 4种溶液pH的大小顺序:①>④>③>② | |
| B. | 等体积的①和②溶液混合后pH>7,c(NH3•H2O)>c( NH4+) | |
| C. | 溶液①、③由水电离产生的c(OH-):①<③ | |
| D. | 溶液③、④等体积混合后,溶液中c(CO32-)>c(HCO3-) |
分析 A.氨水是弱碱溶液,NH4Cl是强酸弱碱盐,Na2CO和NaHCO3是强碱弱酸盐,依据溶液中的溶质电离和水解程度分析判断;
B.等体积的①和②溶液混合后pH>7,说明一水合氨电离程度大于铵根离水解程度;
C.酸或碱抑制水电离,含有弱离子的盐促进水电离;
D.碳酸根离子水解程度远远大于碳酸氢根离子水解程度.
解答 解:A.氨水是弱碱溶液,NH4Cl是强酸弱碱盐,Na2CO和NaHCO3是强碱弱酸盐,4种溶液的pH的大小顺序:①>③>④>②,故A错误;
B.①、②混合后pH>7,则混合溶液中NH3•H2O的电离程度大于NH4+的水解程度,混合溶液中c(NH4+)>c(NH3•H2O),故B错误;
C.酸或碱抑制水电离,含有弱离子的盐促进水电离,所以一水合氨抑制水电离、碳酸钠促进水电离,则溶液①、③由水电离产生的c(OH-):①<③,故C正确;
D.碳酸根离子水解程度远远大于碳酸氢根离子水解程度,则溶液③、④等体积混合后,溶液中c(CO32-)<c(HCO3-),故D错误;
故选C.
点评 本题考查了盐的水解、溶液中离子浓度大小比较,题目难度中等,该题是高考中的常见题型,属于中等难度的试题;试题注重基础,侧重考查学生分析问题、解决问题的能力;该题的关键是明确溶液中几个重要守恒关系,即电荷守恒、物料守恒和质子守恒,易错选项是D.

练习册系列答案
相关题目
9.钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙,TiCl4是生产金属钛的原料.
(1)工业上主要用TiO2氯化的方法来制取TiCl4
①有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g),写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因加入的碳单质与氧气反应,减小了产物O2的浓度,使 TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)平衡向正反应方向移动,使反应能够顺利进行.
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置如图1所示:

如表是有关物质的性质:
①实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是先排尽系统(装置)中的空气.
②本实验中仪器a采用题给的加热方式的突出优点是受热均匀,能为反应提供稳定的CCl4蒸汽流.
③B中CCl4与TiO2发生反应的化学方程式是TiO2+CCl4$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+CO2↑.
④欲分离C装置中的TiCl4,应采用的实验操作为蒸馏(填操作名称).
⑤若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图2所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为NaHCO3,从b点到c点,沉淀减少过程中发生反应的离子方程式为BaCO3+H2O+CO2=Ba2++2HCO3-.
(1)工业上主要用TiO2氯化的方法来制取TiCl4
①有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g),写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因加入的碳单质与氧气反应,减小了产物O2的浓度,使 TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)平衡向正反应方向移动,使反应能够顺利进行.
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置如图1所示:

如表是有关物质的性质:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
②本实验中仪器a采用题给的加热方式的突出优点是受热均匀,能为反应提供稳定的CCl4蒸汽流.
③B中CCl4与TiO2发生反应的化学方程式是TiO2+CCl4$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+CO2↑.
④欲分离C装置中的TiCl4,应采用的实验操作为蒸馏(填操作名称).
⑤若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图2所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为NaHCO3,从b点到c点,沉淀减少过程中发生反应的离子方程式为BaCO3+H2O+CO2=Ba2++2HCO3-.
10.如图图示与对应的叙述相符的是( )
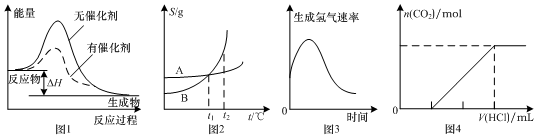

| A. | 图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| C. | 图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应 | |
| D. | 图4表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1 mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |
7.用如图装置测定水中氢、氧元素的质量比,方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H):m(O)>1:8.下列对导致这一结果的原因的分析中,不正确的是( )


| A. | Ⅰ、Ⅱ装置之间缺少干燥装置 | B. | Ⅱ装置中玻璃管内有水冷凝 | ||
| C. | Ⅱ装置中CuO没有全部被还原 | D. | Ⅲ装置后缺少干燥装置 |
14.某化合物的结构(键线式)及球棍模型如图1:该有机分子的核磁共振波谱图如图2(单位是ppm).下列关于该有机物的叙述正确的是( )
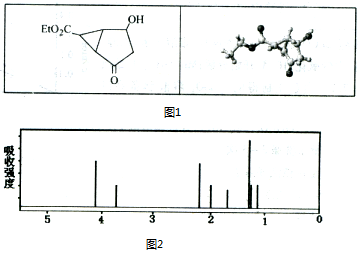

| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物在一定条件下能够发生加成反应、取代反应,但不能发生消去反应 |
4.下列反应的离子方程式书写正确的是( )
| A. | 铜溶于FeCl3溶液:3Cu+2Fe3+═3Cu2++2Fe | |
| B. | 碳酸钙溶于醋酸:CO32-+2H+═CO2↑+H2O | |
| C. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | Ba(OH)2溶液中加入过量NaHCO3溶液:Ba2++HCO3-+OH-═BaCO3↓+H2O |
11.如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法不正确的是
( )
( )
| R | ||
| X | Y | Z |
| A. | 元素X的最高价氧化物对应水化物的化学式为H3PO4 | |
| B. | 元素Y有两种常见的氧化物且都能与元素R的氢化物反应生成对应价态的酸 | |
| C. | R、X、Y三者的气态氢化物稳定性依次增强 | |
| D. | Z的单质能与Y的某些化合物发生置换反应 |
 ;其中所含有的化学键类型为离子键、共价键;
;其中所含有的化学键类型为离子键、共价键;