题目内容
18.铝氢化钠(NaAlH4)是有机合成的重要还原剂,其合成线路如图所示.
(1)实验室利用如图装置制取无水AlC13.A中所盛装的试剂的名称高锰酸钾(氯酸钾或重铬酸钾)

(2)改变A、B试管中和D中的试剂就可以用该装置制取NaH.最好将B试管中原来的试剂改为氢氧化钠溶液,如果操作不当,制得的NaH中可能含有Na、Na2O2杂质.
(3)现设计如图四种装置测定铝氧化钠样品的纯度(假设杂质不参与反应).从简约性、准确性考虑,最适宜的方案是乙(填编号).铝氢化钠与水完全反应,冷却至室温的标志是连续两次读数的氢气体积相等.

分析 (1)氯化铝的制备是金属铝和氯气之间反应的产物,浓盐酸和高锰酸钾(氯酸钾或重铬酸钾)之间无条件的反应产物是氯气,但是金属铝易被氧气氧化而变质,所以点燃D处酒精灯之前需排除装置中的空气;
(2)金属钠和氢气之间化合可以得NaH,但是氢气中的氯化氢要除去,金属钠和氧气加热下会产生过氧化钠杂质,据此回答;
(3)由反应原理得,测定铝氢化钠样品的纯度即通过测定铝氢化钠与水反应生成的氢气的量计算铝氢化钠的量,从而计算其纯度.
解答 解:(1)氯化铝的制备是金属铝和氯气之间反应的产物,则装置A为制备氯气的发生装置,浓盐酸和高锰酸钾(氯酸钾或重铬酸钾)之间无条件的反应产物是氯气,所以A中所盛装的试剂的名称为高锰酸钾(氯酸钾或重铬酸钾),
故答案为:高锰酸钾(氯酸钾或重铬酸钾);
(2)制取NaH则用金属钠和氢气化合可以得到,所以A装置为氢气的发生装置,B为除去氢气中的HCl气体,所以用氢氧化钠溶液,而原来是除去氯气中的HCl用的是饱和食盐水;又由于装置中会有空气残留,所以金属钠和氧气加热下会产生过氧化钠杂质,再加上有钠剩余,则如果操作不当,制得的NaH中可能含有Na、Na2O2,
故答案为:氢氧化钠溶液;Na、Na2O2;
(3)由反应原理得,测定铝氢化钠样品的纯度即通过测定铝氢化钠与水反应生成的氢气的量计算铝氢化钠的量,从而计算其纯度,所以从简约性、准确性考虑,最甲没有使用恒压漏斗,测出的氢气有误差;C、D采用排水法收集氢气,由于导管中会有残留,导致测出的氢气有误差,适宜的方案是乙;通过连续两次读数的氢气体积相等,说明铝氢化钠与水完全反应,冷却至室温,
故答案为:乙;连续两次读数的氢气体积相等.
点评 本题考查知识点较多,涉及方程式的书写、装置图的选择、物质的制备和除杂等元素化合物的性质,属于拼合型题目,需要学生具备扎实的基础,难度中等.

(1)工业上主要用TiO2氯化的方法来制取TiCl4
①有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g),写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因加入的碳单质与氧气反应,减小了产物O2的浓度,使 TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)平衡向正反应方向移动,使反应能够顺利进行.
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置如图1所示:

如表是有关物质的性质:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
②本实验中仪器a采用题给的加热方式的突出优点是受热均匀,能为反应提供稳定的CCl4蒸汽流.
③B中CCl4与TiO2发生反应的化学方程式是TiO2+CCl4$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+CO2↑.
④欲分离C装置中的TiCl4,应采用的实验操作为蒸馏(填操作名称).
⑤若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图2所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为NaHCO3,从b点到c点,沉淀减少过程中发生反应的离子方程式为BaCO3+H2O+CO2=Ba2++2HCO3-.
| A. | 浓硫酸具有脱水性,因此实验室可用浓硫酸与浓盐酸制取少量HCl气体 | |
| B. | 钠是活泼金属,可用电解NaCl溶液的方法获得金属钠 | |
| C. | 碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污 | |
| D. | 在电热水器的钢铁内胆中装入铜棒可以防止内胆被腐蚀 |

| A. | 三溴化铝溶液 | B. | 偏铝酸钠溶液 | C. | 明矾溶液 | D. | 硝酸铝溶液 |
| A. | 标准状况下,11.2 L CCl4中含有的分子数为0.5NA | |
| B. | 在Na2O2与水的反应中,每生成1 mol O2,转移电子的数为2NA | |
| C. | 常温常压下,7.8 g苯中含有双键的数目为0.3NA | |
| D. | 25℃时,0.1 mol•L-1 NH4NO3溶液中含有的铵根离子数为0.1NA |
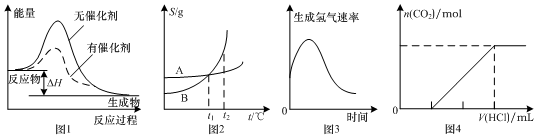
| A. | 图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| C. | 图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应 | |
| D. | 图4表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1 mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |

| A. | Ⅰ、Ⅱ装置之间缺少干燥装置 | B. | Ⅱ装置中玻璃管内有水冷凝 | ||
| C. | Ⅱ装置中CuO没有全部被还原 | D. | Ⅲ装置后缺少干燥装置 |
