题目内容
20.某班同学用如下实验探究Na2CO3、NaHCO3的性质.回答下列问题:(1)甲组同学分别取1.0g Na2CO3、NaHCO3固体,各滴加几滴水,发现盛Na2CO3的试管温度上升,而盛NaHCO3的试管温度下降;原因是碳酸钠与水反应生成Na2CO3•xH2O,属于放热反应;NaHCO3只有溶解扩散现象,吸收热量.
(2)乙组同学分别取0.1mol/L Na2CO3、0.1mol/LNaHCO3的溶液,用0.1mol/LHCl溶液滴定,pH变化与盐酸体积的关系如图所示:

①碳酸钠与盐酸反应pH有两次突变,达到两次反应终点,分别是BC(填A、B、C、D或E).
②B点的主要溶质是NaCl和NaHCO3(用化学式表示).
③B点小于(填“大于”或“小于”) D点的pH,主要原因是B点溶液溶解了少量二氧化碳,同时NaHCO3的浓度低于D点.
(3)丙组同学预测NaHCO3有酸性,向其溶液加入镁粉,发现有气泡和沉淀生成,写出化学方程式:2NaHCO3+Mg=MgCO3↓+Na2CO3+H2↑.
分析 (1)Na2CO3、NaHCO3固体,各滴加几滴水,是碳酸钠与水反应生成结晶水合物,是放热反应,而碳酸氢钠是溶解于水是吸热的过程;
(2)①碳酸钠与盐酸反应首先碳酸钠转化为碳酸氢钠,然后碳酸氢钠与盐酸反应生成氯化钠;
②由①知B点的主要溶质是NaCl和NaHCO3;
③B点溶液溶解了少量二氧化碳,使溶液呈酸性,同时B点碳酸氢钠的浓度小于D点碳酸氢钠的浓度,所以B点的PH小于D点的PH;
(3)NaHCO3有酸性,所以碳酸氢根离子电离产生氢离子和碳酸根离子,氢离子与镁反应生成氢气和镁离子,由此分析解答.
解答 解:(1)Na2CO3、NaHCO3固体,各滴加几滴水,是碳酸钠与水反应生成结晶水合物,是放热反应,而碳酸氢钠是溶解于水是吸热的过程,故答案为:碳酸钠与水反应生成Na2CO3•xH2O,属于放热反应;NaHCO3只有溶解扩散现象,吸收热量;
(2)①碳酸钠与盐酸反应首先碳酸钠转化为碳酸氢钠,所以第一次溶液呈碱性,达到两次反应终点是B,然后碳酸氢钠与盐酸反应生成氯化钠,呈中性,达到两次反应终点是C,故选:BC;
②由①知B点的主要溶质是NaCl和NaHCO3,故答案为:NaCl和NaHCO3;
③B点溶液溶解了少量二氧化碳,使溶液呈酸性,同时B点碳酸氢钠的浓度小于D点碳酸氢钠的浓度,所以B点的PH小于D点的PH,故答案为:小于;B点溶液溶解了少量二氧化碳,同时NaHCO3的浓度低于D点;(3)NaHCO3有酸性,所以碳酸氢根离子电离产生氢离子和碳酸根离子,氢离子与镁反应生成氢气和镁离子,所以反应方程式为:2NaHCO3+Mg=MgCO3↓+Na2CO3+H2↑,故答案为:2NaHCO3+Mg=MgCO3↓+Na2CO3+H2↑.
点评 本题主要考查碳酸钠和碳酸氢钠与酸反应的知识,难度中等,注酸钠酸的性质的灵活用,碳酸钠与酸反应首先生成碳酸氢钠,然后碳酸氢钠与盐酸反应生成氯化钠.

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案(1)恒容密闭窗口中,工业固氮反应N2(g)+3H2(g)?2NH3(g)的化学平衡常数K和温度的关系如表所示:
| 温度/℃ | 25 | 200 | 300 | 400 | 500 |
| K | 5×108 | 1.0 | 0.86 | 0.507 | 0.152 |
②有关工业合成氨的研究成果,曾于1918年、1931年、2007年三次荣膺诺贝尔化学奖.
下列关于合成氨反应描述的图象中,不正确的是C(填序号).
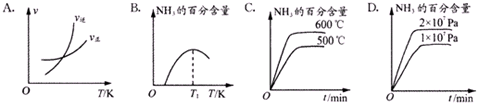
③400℃时,测得某时刻氨气、氮气、氢气物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1,则该反应的v正<v逆(填“>”、“<”或“=”)
(2)近年来,科学家又提出在常温、常压、催化剂等条件下合成氨的新思路,反应原理为:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),则其反应热△H=+1530kJ•mol-1.[已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)?2H2O(1)△H=-571.6kJ•mol-1]
(3)联氨(N2H4)、二氧化氮(NO2)可与KOH溶液构成碱性燃料电池,其电池反应原理为2N2H4+2NO2═3N2+4H2O,则负极的电极反应式为N2H4-4e-+4OH-=N2+4H2O.
(4)25℃时,将pH=3的盐酸和pH=11的氨水等体积混合后,溶液中的离子浓度由大到小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+).
(5)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液中c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+)(填表达式).(已知:H2SO3的Ka1=1.7×10-2mol•L-1,Ka2=6.0×10-8mol•L-1;NH3•H2O的Kb=1.8×10-5mol•L-1)
| A. | 常温常压下,20gH218O中含有中子数目为12NA | |
| B. | 标准状况下,11.2LC2H6中含有极性键的数目为3.5NA | |
| C. | 1LpH=3的CH3COOH溶液中,含有H+的数目大于10-3NA | |
| D. | 1L1mol•L-1稀硝酸(还原产物为NO)与铁完全反应,转移电子数目为0.75NA |
| A. | 28gMgCO3和NaHCO3混合固体中的CO32-离子数为NA | |
| B. | lmolI2与4molH2反应生成的HI分子数为2NA | |
| C. | 1molAl溶于含1molNaOH溶液,电子转移数为3NA | |
| D. | 标准状况下,2.24LH2O含有的共价键数为0.2NA |
| A. | 金属钠投入CuSO4溶液中:2Na+Cu2+═2Na++Cu | |
| B. | 过量的CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O═HCO3-+HClO | |
| C. | 向Mg(OH)2悬浊液中滴加四滴0.1mol•L-1FeCl3溶液:3Mg(OH)2(S)+2Fe3+(aq)═2Fe(OH)3(S)+3Mg2+(aq) | |
| D. | 铅酸蓄电池充电时的阳极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
(1)工业上主要用TiO2氯化的方法来制取TiCl4
①有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g),写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因加入的碳单质与氧气反应,减小了产物O2的浓度,使 TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)平衡向正反应方向移动,使反应能够顺利进行.
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置如图1所示:

如表是有关物质的性质:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
②本实验中仪器a采用题给的加热方式的突出优点是受热均匀,能为反应提供稳定的CCl4蒸汽流.
③B中CCl4与TiO2发生反应的化学方程式是TiO2+CCl4$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+CO2↑.
④欲分离C装置中的TiCl4,应采用的实验操作为蒸馏(填操作名称).
⑤若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图2所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为NaHCO3,从b点到c点,沉淀减少过程中发生反应的离子方程式为BaCO3+H2O+CO2=Ba2++2HCO3-.
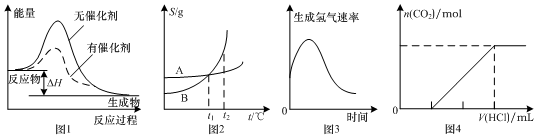
| A. | 图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| C. | 图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应 | |
| D. | 图4表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1 mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |

