题目内容
1.近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染.
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ/mol.
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200kJ•mol-1
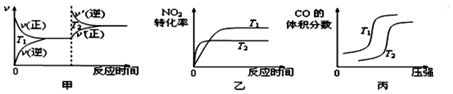
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).
(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如表:
| 时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.3 0 | 0.36 | 0.36 |
②30min后,只改变某一条件,根据表的数据判断改变的条件可能是CD(填字母代号).
A.通入一定量的CO2 B.加入合适的催化剂
C.适当缩小容器的体积 D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率降低(填“升高”或“降低”),a<0(填“>”或“<”).
(4)温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入1L的密闭容器中发生反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H=bkJ/mol.测得有关数据如表:
| 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
A.T1>T2,且b>0
B.当温度为T2、反应进行到40min时,x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50mol CH4和1.2mol NO2,重新达到平衡时,n(N2)<0.70mol
D.温度为T1时,若起始时向容器中充入0.50mol CH4(g)、0.50molNO2(g)、1.0mol N2(g)、2.0molCO2(g)、0.50molH2O(g),反应开始时,ν(正)>ν(逆)
分析 (1)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
由盖斯定律[①+②-③×4]×$\frac{1}{2}$可得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l);
(2)该反应中焓变小于0,为放热反应,升高温度,正逆反应速率都增大,且反应向着逆向进行,二氧化氮转化率减小、一氧化碳的体积含量减小,据此对各图象进行判断;
(3)①根据v=$\frac{△c}{△t}$计算反应速率,K=$\frac{c({N}_{2})•c(C{O}_{2})}{{c}^{2}(NO)}$计算化学平衡常数K;
②依据图表数据分析,结合平衡浓度计算平衡常数和浓度变化分析判断,30min后,只改变某一条件,反应重新达到平衡,C(s)+2NO(g)?N2(g)+CO2(g),依据图表数据分析,平衡状态物质浓度增大,依据平衡常数计算,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,所以可能是减小溶液体积后加入一定量一氧化氮;
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比从为2:1:1,氮气和二氧化碳难度之比始终为1:1,所以2:1>4:3,说明平衡向逆反应方向移动;
(4)A、温度升高,反应速率加快,甲烷剩余量增多,说明反应向左进行,正反应放热;
B、温度升高,反应速率加快,当温度为T1、反应进行到40 min时已达平衡状态,温度为T2时反应也应该达到平衡状态;
C、温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,可等效为在另一个相同的容器中建立一个和原平衡相同的平衡状态,再压缩到一个容器中,即为增大压强,平衡逆向移动;
D、根据温度为T1时平衡常数不变,根据浓度商与平衡常数的大小判断平衡移动方向,利用化学平衡三段式计算.
解答 解:(1)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
由盖斯定律[①+②-③×4]×$\frac{1}{2}$可得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ/mol;
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ/mol;
(2)该反应为放热反应,升高温度,正逆反应速率均增大,都应该离开原来的速率点,图象与实际情况不相符,故甲错误;
升高温度,反应向着逆向进行,反应物的转化率减小,反应速率加快,图象与实际反应一致,故乙正确;
压强相同时,升高温度,反应向着逆向移动,一氧化氮的体积分数应该增大,图象与实际不相符,故丙错误;
故答案为:乙;
(3)①T1℃时,该反应在0-20min的平均反应速率v(NO)=$\frac{1mol/L-0.4mol/L}{20min}$=0.030mol•L-1•min-1;
C(s)+2NO(g)?N2(g)+CO2(g),平衡浓度c(N2)=0.3mol/L;c(CO2)=0.3mol/L;c(NO)=0.4mol/L;反应的平衡常数K=$\frac{0.3×0.3}{0.{4}^{2}}$=0.56;
故答案为:0.030mol•L-1•min-1;0.56;
②A.通入一定量的CO2,平衡逆向移动,NO的浓度增大,但是氮气的浓度会减少,与题不符,故A错误;
B.催化剂只改变化学反应速率,不改变化学平衡,故B错误;
C.适当缩小容器的体积,反应前后体积不变,平衡状态物质浓度增大,故C正确;
D.通入一定量的NO,新平衡状态下物质平衡浓度增大,故D正确;
E.加入一定量的活性炭,碳是固体对平衡无影响,平衡不动,故E错误;
故答案为:CD;
③30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比从为2:1:1,氮气和二氧化碳难度之比始终为1:1,所以2:1>4:3,说明平衡向逆反应方向移动,说明平衡向逆反应方向移动,达到新平衡时NO的转化率,说明逆反应是吸热反应,则正反应是放热反应;
故答案为:降低;<;
(4)A、温度升高,反应速率加快,因此T2>T1,甲烷剩余量增多,说明反应向左进行,正反应放热,所以a<0,故A错误;
B、当温度为T2、反应进行到40 min时,反应达到平衡状态,x=0.15,故B错误;
C、温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,平衡逆向移动,重新达到平衡时,n(N2)小于原平衡n(N2)的2倍,故C正确;
D、对于反应 CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)
起始(mol/L) 0.5 1.2 0 0 0
变化(mol/L) 0.4 0.8 0.4 0.4 0.8
平衡(mol/L) 0.1 0.4 0.4 0.4 0.8
温度为T1时,平衡常数K=$\frac{0.{8}^{2}×0.4×0.4}{0.1×0.{4}^{2}}$=6.4,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50 molH2O(g),浓度商Qc=$\frac{0.{5}^{2}×2×1}{0.5×0.{5}^{2}}$=4<K,平衡正向移动,ν(正)>ν(逆),故D正确;
故答案为:CD.
点评 本题考查了盖斯定律的应用、影响平衡移动的因素、平衡常数的有关计算等,综合性较强,侧重分析及计算能力的考查,把握化学平衡常数的有关计算为解答的关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 常温常压下,20gH218O中含有中子数目为12NA | |
| B. | 标准状况下,11.2LC2H6中含有极性键的数目为3.5NA | |
| C. | 1LpH=3的CH3COOH溶液中,含有H+的数目大于10-3NA | |
| D. | 1L1mol•L-1稀硝酸(还原产物为NO)与铁完全反应,转移电子数目为0.75NA |
(1)工业上主要用TiO2氯化的方法来制取TiCl4
①有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g),写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因加入的碳单质与氧气反应,减小了产物O2的浓度,使 TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)平衡向正反应方向移动,使反应能够顺利进行.
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置如图1所示:

如表是有关物质的性质:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
②本实验中仪器a采用题给的加热方式的突出优点是受热均匀,能为反应提供稳定的CCl4蒸汽流.
③B中CCl4与TiO2发生反应的化学方程式是TiO2+CCl4$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+CO2↑.
④欲分离C装置中的TiCl4,应采用的实验操作为蒸馏(填操作名称).
⑤若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图2所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为NaHCO3,从b点到c点,沉淀减少过程中发生反应的离子方程式为BaCO3+H2O+CO2=Ba2++2HCO3-.
| A. | 墨水是一种胶体,不同墨水混用时可能使钢笔流水不畅或者堵塞 | |
| B. | 持续加热到一定温度能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性 | |
| C. | 洁厕液与84消毒液混合洗厕所可以达到洗涤和消毒杀菌的双重功效,对人体不可能造成伤害 | |
| D. | 用13C示踪原子法可以进行幽门螺旋杆菌的精确检测 |
| A. | 浓硫酸具有脱水性,因此实验室可用浓硫酸与浓盐酸制取少量HCl气体 | |
| B. | 钠是活泼金属,可用电解NaCl溶液的方法获得金属钠 | |
| C. | 碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污 | |
| D. | 在电热水器的钢铁内胆中装入铜棒可以防止内胆被腐蚀 |

| A. | 三溴化铝溶液 | B. | 偏铝酸钠溶液 | C. | 明矾溶液 | D. | 硝酸铝溶液 |
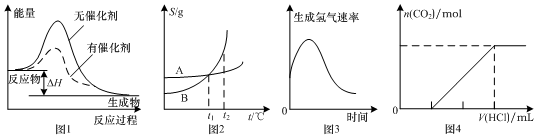
| A. | 图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| C. | 图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应 | |
| D. | 图4表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1 mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |
( )
| R | ||
| X | Y | Z |
| A. | 元素X的最高价氧化物对应水化物的化学式为H3PO4 | |
| B. | 元素Y有两种常见的氧化物且都能与元素R的氢化物反应生成对应价态的酸 | |
| C. | R、X、Y三者的气态氢化物稳定性依次增强 | |
| D. | Z的单质能与Y的某些化合物发生置换反应 |
