题目内容
17. (1)基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(1)基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.(2)金属锂氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)Cu2+基态的电子排布式为1s22s22p63s23p63d9sp3;向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4•H2O晶体,硫酸根离子中硫原子的杂化方式为sp3;不考虑空间构型,其内界结构可用示意图表示为
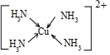 .
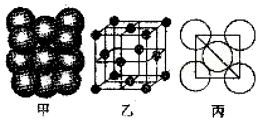
.(4)某单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示,若已知该原子半径为d,NA表示阿伏伽德罗常数.摩尔质量为M,则该原子的配位数为12,该晶体的密度可表示为$\frac{{M}_{r}}{4\sqrt{2}(d×1{0}^{-10})^{3}{N}_{A}}$.
分析 (1)Cl原子的核外电子排布式为1s22s22p63s23p5,有三层,离原子核越远的电子层其能量越高;该原子第三层即M层中含有1个s轨道、3个p轨道、5个d轨道;
(2)①核外电子排布相同的离子,核电荷数越大,离子半径越小;
②该元素的第III电离能剧增,则该元素属于第IIA族;
(3)根据Cu的电子排布式书写Cu2+离子的电子排布式,注意原子形成离子先失去高能层中高能级电子;根据SO42-中心原子含有的共价键个数与孤电子对个数之和确定其空间构型和杂化方式;Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键;
(4)根据晶胞结构知,该原子配位数=3×8÷2=12,根均摊法计算出该晶胞中原子个数4,根据晶胞密度=$\frac{M×4}{\frac{{N}_{A}}{V}}$计算.
解答 解:(1)Cl原子的核外电子排布式为1s22s22p63s23p5,有三层,离原子核越远的电子层其能量越高;该原子第三层即M层中含有该能层有1个s轨道、3个p轨道、5个d轨道,共有9 个原子轨道,
故答案为:M;9;
(2)①核外电子排布相同,核电荷数越大,离子半径越小,锂的质子数为3,氢的质子数为1,Li+、H-核外电子数都为2,所以半径Li+<H-,
故答案为:<;
②该元素的第III电离能剧增,则该元素属于第IIA族,为Mg元素,
故答案为:Mg;
(3)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,铜原子失去4s及3d上各一个电子形成Cu2+,故Cu2+离子的电子排布式为:1s22s22p63s23p63d9,SO42-离子中含有4个σ键,没有孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化;
Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键,内界结构用示意图表示为 ,
,
故答案为:1s22s22p63s23p63d9;sp3; .
.
(4)根据晶胞结构知,该原子配位数=3×8÷2=12;晶胞棱长=$\frac{\sqrt{2}}{2}$×4d=2$\sqrt{2}$d,晶胞体积=(2$\sqrt{2}$d×10-10 m)3,该晶胞中原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞密度=$\frac{M×4}{\frac{{N}_{A}}{V}}$=$\frac{{M}_{r}}{4\sqrt{2}(d×1{0}^{-10})^{3}{N}_{A}}$,
故答案为:12;$\frac{{M}_{r}}{4\sqrt{2}(d×1{0}^{-10})^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,涉及核外电子排布、电离能、杂化方式的判断、晶胞的计算等知识点,难点是晶胞的计算,灵活运用公式是解本题关键,难度中等.

| A. | Ba2+ | B. | OH- | C. | I- | D. | NH4+ |
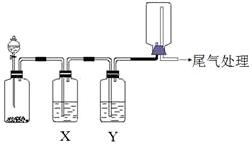 利用图装置可以进行实验并能达到实验目的是( )
利用图装置可以进行实验并能达到实验目的是( )| 选项 | 实验目的 | X中试剂 | Y中试剂 |
| A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
| C | 用CaO于浓氨水制取并收集纯净干燥的NH3 | NaOH溶液 | 碱石灰 |
| D | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | |
| B. | 等物质的量的苯与苯甲酸完全燃烧消耗氧气的量相等 | |
| C. | 某单官能团有机化合物,只含碳、氢、氧三种元素,相对分子质量为58,完全燃烧时产生等物质的量的CO2和H2O.它可能的结构共有5种 | |
| D. | 1mol 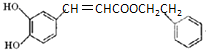 可消耗3 molNaOH、3molBr2、7molH2 可消耗3 molNaOH、3molBr2、7molH2 |
| A. | 新买的衣服先用水清洗,可除去衣服上残留的有防皱作用的甲醛整理剂 | |
| B. | 硅胶是一种无毒无味,吸附水能力强的物质,常用作袋装食品的干燥剂 | |
| C. | 纤维的应用很广,人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| D. | 合金的生成常会改善金属单质的性质,日常生活中合金的使用范围远大于纯金属 |
| A. | 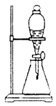 用图所示装置可以将乙醇和水分离 | |
| B. | 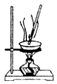 用图所示装置蒸发硫酸铜溶液制备硫酸铜晶体 | |
| C. | 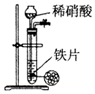 用图所示装置通过稀硝酸与铁反应制取少量的氢气 | |
| D. | 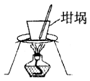 用图所示装置分离氢氧化钙固体中混有的少量氯化铵固体 |
| A. | 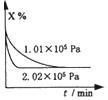 图表示不同压强对反应体系3X(g)?2Y(g)+Z(s)中X体积分数的影响 | |
| B. |  图表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 | |
| C. | 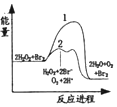 图中的线条2表示放热反应2H2O2═2H2O+O2加入催化剂Br2的反应进程 | |
| D. | 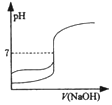 图表示用0.1000mol•L-1NaOH溶液分别滴定同浓度同体积盐酸和醋酸的曲线 |
| A. | Li2SO4难溶于水 | B. | LiOH加热时,不会分解 | ||
| C. | Li遇浓H2SO4发生钝化 | D. | Li2CO3加热时,分解成Li2O和CO2 |
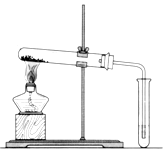 碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.
碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.