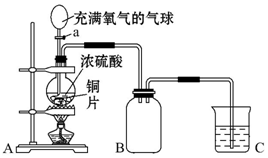
题目内容
5.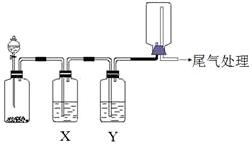 利用图装置可以进行实验并能达到实验目的是( )
利用图装置可以进行实验并能达到实验目的是( )| 选项 | 实验目的 | X中试剂 | Y中试剂 |
| A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
| C | 用CaO于浓氨水制取并收集纯净干燥的NH3 | NaOH溶液 | 碱石灰 |
| D | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.MnO2和浓盐酸反应需要加热;
B.NO不能利用排空气法收集;
C.氨气的密度比空气的密度小;
D.反应生成二氧化碳,碳酸氢钠溶液除去HCl,浓硫酸干燥,最后利用向上排空气法收集.
解答 解:A.MnO2和浓盐酸反应需要加热,图中缺少加热装置,不能制备氯气,故A错误;
B.NO不能利用排空气法收集,因NO与氧气反应,应排水法收集,故B错误;
C.氨气的密度比空气的密度小,不能用向上排空气法收集,故C错误;
D.反应生成二氧化碳,碳酸氢钠溶液除去HCl,浓硫酸干燥,最后利用向上排空气法收集,则均合理,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、物质的制备实验、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
16.如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )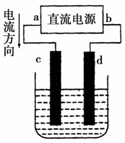

| A. | a为负极、b为正极 | B. | c为阴极、d为阳极 | ||
| C. | 电解过程中,d电极质量不变 | D. | 电解过程中,氯离子浓度减小 |
13.用下列图示操作,装置正确且能达到实验目的是( )
| A. |  制取氨气 | B. |  干燥氯气 | C. |  转移溶液 | D. |  萃取溴 |
20.下列实验方法能达到实验目的是( )
| A. | 用湿润的红色石蕊试纸检验氨气 | |
| B. | 用长颈漏斗分离碘的四氯化碳溶液和水溶液 | |
| C. | 用焰色反应鉴别NaCl和Na2SO4两种无色晶体 | |
| D. | 用KSCN溶液鉴别FeCl3溶液和Fe(NO3)3溶液 |
10.下列与化学有关的说法中正确的是( )
| A. | 在0.1mol/lHNO3溶液中加入FeCO3粉末,发生反应的离子方程式为:2FeCO3+2H+═2Fe2++CO2↑+H2O | |
| B. | 在$\frac{c(O{H}^{-})}{c({H}^{+})}$=1010的溶液中NO3-、I-、Na+、SO42-不能大量共存 | |
| C. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1 NA | |
| D. | 闭容器中2molNO与1molO2充分反应,产物的分子数小于2NA |
17. (1)基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(1)基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(2)金属锂氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
M是Mg(填元素符号).
(3)Cu2+基态的电子排布式为1s22s22p63s23p63d9sp3;向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4•H2O晶体,硫酸根离子中硫原子的杂化方式为sp3;不考虑空间构型,其内界结构可用示意图表示为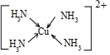 .
.
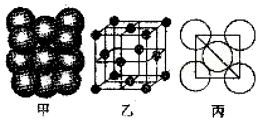
(4)某单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示,若已知该原子半径为d,NA表示阿伏伽德罗常数.摩尔质量为M,则该原子的配位数为12,该晶体的密度可表示为$\frac{{M}_{r}}{4\sqrt{2}(d×1{0}^{-10})^{3}{N}_{A}}$.
 (1)基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(1)基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.(2)金属锂氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)Cu2+基态的电子排布式为1s22s22p63s23p63d9sp3;向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4•H2O晶体,硫酸根离子中硫原子的杂化方式为sp3;不考虑空间构型,其内界结构可用示意图表示为
 .
.(4)某单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示,若已知该原子半径为d,NA表示阿伏伽德罗常数.摩尔质量为M,则该原子的配位数为12,该晶体的密度可表示为$\frac{{M}_{r}}{4\sqrt{2}(d×1{0}^{-10})^{3}{N}_{A}}$.
14.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
| 操 作 | 现 象 | 结 论 | |
| A | 滴加稀NaOH溶液,将红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| B | 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42- |
| C | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| A. | A | B. | B | C. | C | D. | D |
1.有关反应原理说法错误的是( )
| A. | 碳酸钙与盐酸反应过程中,再增加CaCO3固体的量,反应速率不变,但把CaCO3固体粉碎,可以加快反应速率 | |
| B. | 增大反应体系的压强,反应速率不一定增大 | |
| C. | 由温度或压强改变引起的平衡正向移动,反应物的转化率一定增大 | |
| D. | 对于2SO2(g)+O2(g)?2SO3(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志 |