题目内容
12.下列说法中,错误的是( )| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | |
| B. | 等物质的量的苯与苯甲酸完全燃烧消耗氧气的量相等 | |
| C. | 某单官能团有机化合物,只含碳、氢、氧三种元素,相对分子质量为58,完全燃烧时产生等物质的量的CO2和H2O.它可能的结构共有5种 | |
| D. | 1mol 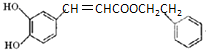 可消耗3 molNaOH、3molBr2、7molH2 可消耗3 molNaOH、3molBr2、7molH2 |
分析 A.乙酸可与碳酸钠反应,乙酸乙酯不溶于饱和碳酸钠溶液;
B.苯(C6H6)与苯甲酸(C6H6.CO2),消耗氧气均由C6H6决定;
C.完全燃烧时产生等物质的量的CO2和H2O,且C、H的比值为1:2,分子式为C3H6O,可为醛、酮等;
D.能与氢氧化钠反应的为酚羟基和酯基,与溴水反应的酚羟基邻位、对位的取代以及碳碳双键的加成,与氢气反应的为苯环和碳碳双键.
解答 解:A.乙酸可与碳酸钠反应,乙酸乙酯不溶于饱和碳酸钠溶液,可用饱和碳酸钠溶液鉴别,故A正确;
B.苯(C6H6)与苯甲酸(C6H6.CO2),消耗氧气均由C6H6决定,则等物质的量的苯与苯甲酸完全燃烧消耗氧气的量相等,故B正确;
C.由完全燃烧时产生等物质的量的CO2和H2O,不妨设有机化合物为CnH2nOx,若只有1个氧原子,58-16=42,剩下的为碳和氢,14n=42,则碳只能为3个,即为C3H6O,1个不饱和度.若有2个O,那么58-32=26,14n=26,n不可能为分数,则不可能为2个氧原子,所以分子式为C3H6O,再根据官能团异构、碳链异构确定同分异构体的种类:醛一种,酮一种,烯醇一种,三元含氧杂环,三元碳环一种,四元杂环一种,共6种,而由题意可知有机物为单官能团,烯醇应舍去,故C正确;
D.能与氢氧化钠反应的为酚羟基和酯基,需3molNaOH,与溴水反应的酚羟基邻位、对位的取代以及碳碳双键的加成,需要4mol溴,与氢气反应的为苯环和碳碳双键,需要7mol氢气,故D错误.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,选项C为解答的易错点,题目难度不大.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
2.X、Y、Z三种主族元素,已知X+和Y-具有相同的电子层结构,Z元素原子核电荷数比Y元素原子核电荷数少9,Y-在一定条件下可被氧化成YZ3-,则下列说法正确的是( )
| A. | X、Y、Z均属于短周期元素 | |
| B. | 离子半径X+>Y- | |
| C. | X、Y、Z三种元素只能形成化合物XYZ3 | |
| D. | Y的气态氢化物的热稳定性可能较强 |
3.我国首飞的长征七号运载火箭采用液氧和煤油作为推进剂.煤油属于( )


| A. | 纯净物 | B. | 混合物 | C. | 氧化物 | D. | 单质 |
20.下列实验方法能达到实验目的是( )
| A. | 用湿润的红色石蕊试纸检验氨气 | |
| B. | 用长颈漏斗分离碘的四氯化碳溶液和水溶液 | |
| C. | 用焰色反应鉴别NaCl和Na2SO4两种无色晶体 | |
| D. | 用KSCN溶液鉴别FeCl3溶液和Fe(NO3)3溶液 |
7.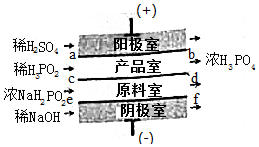 次磷酸(H3PO2)位一元酸,具有较强的还原性.可利用NaH2PO2为原料,通过四室电渗析法制备,工作原理如图所示,采用惰性电极,ab,cd,ef均为只允许阳离子(或阴离子)通过的离子交换膜,分别称为阳膜(或阴离子),下列说法描述错误的是( )
次磷酸(H3PO2)位一元酸,具有较强的还原性.可利用NaH2PO2为原料,通过四室电渗析法制备,工作原理如图所示,采用惰性电极,ab,cd,ef均为只允许阳离子(或阴离子)通过的离子交换膜,分别称为阳膜(或阴离子),下列说法描述错误的是( )
 次磷酸(H3PO2)位一元酸,具有较强的还原性.可利用NaH2PO2为原料,通过四室电渗析法制备,工作原理如图所示,采用惰性电极,ab,cd,ef均为只允许阳离子(或阴离子)通过的离子交换膜,分别称为阳膜(或阴离子),下列说法描述错误的是( )
次磷酸(H3PO2)位一元酸,具有较强的还原性.可利用NaH2PO2为原料,通过四室电渗析法制备,工作原理如图所示,采用惰性电极,ab,cd,ef均为只允许阳离子(或阴离子)通过的离子交换膜,分别称为阳膜(或阴离子),下列说法描述错误的是( )| A. | 阳极室反应为:2H2O-4e-=O2↑+4H+ | |
| B. | ab,ef均为阳膜,cd为阴膜 | |
| C. | 若将稀H2SO4改为H3PO3,撤去ab膜,产品中总混有杂质的原因是:H3PO2在阳极放电而被氧化生成H3PO4 | |
| D. | 通电后产品室中的H+离子向原料室迁移 |
17. (1)基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(1)基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(2)金属锂氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
M是Mg(填元素符号).
(3)Cu2+基态的电子排布式为1s22s22p63s23p63d9sp3;向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4•H2O晶体,硫酸根离子中硫原子的杂化方式为sp3;不考虑空间构型,其内界结构可用示意图表示为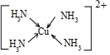 .
.
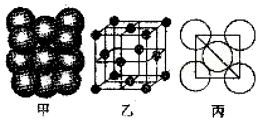
(4)某单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示,若已知该原子半径为d,NA表示阿伏伽德罗常数.摩尔质量为M,则该原子的配位数为12,该晶体的密度可表示为$\frac{{M}_{r}}{4\sqrt{2}(d×1{0}^{-10})^{3}{N}_{A}}$.
 (1)基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(1)基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.(2)金属锂氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)Cu2+基态的电子排布式为1s22s22p63s23p63d9sp3;向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4•H2O晶体,硫酸根离子中硫原子的杂化方式为sp3;不考虑空间构型,其内界结构可用示意图表示为
 .
.(4)某单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示,若已知该原子半径为d,NA表示阿伏伽德罗常数.摩尔质量为M,则该原子的配位数为12,该晶体的密度可表示为$\frac{{M}_{r}}{4\sqrt{2}(d×1{0}^{-10})^{3}{N}_{A}}$.
4.25℃时,下列离子组在给定条件下可能大量共存的是( )
| A. | 使甲基橙显红色的溶液中:Fe2+、ClO-、Na+、SO42- | |
| B. | 溶有少量NaOH的溶液中:NH4+、Mg2+、HCO3-、NO3- | |
| C. | 水电离出的c(H+)=1.0×10-12mol•L-1溶液中:K+、Na+、S2-、SO32- | |
| D. | 溶有大量FeCl3的溶液中:NH4+、Na+、CI-、SCN- |
1.下列有关化学用语表示正确的是( )
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | 硫离子的结构示意图: | ||
| C. | N2H4的电子式: | D. | 丙烯的结构简式:CH2CHCH3 |
8.在NaCl和Na2SO4的混合溶液中,Na+、SO42-、Cl-的物质的量浓度之比不可能出现的是( )
| A. | 8:3:2 | B. | 6:2:3 | C. | 5:2:1 | D. | 3:1:1 |