题目内容
2.化学已渗透到人类生活的各个方面.下列说法错误的是( )| A. | 新买的衣服先用水清洗,可除去衣服上残留的有防皱作用的甲醛整理剂 | |
| B. | 硅胶是一种无毒无味,吸附水能力强的物质,常用作袋装食品的干燥剂 | |
| C. | 纤维的应用很广,人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| D. | 合金的生成常会改善金属单质的性质,日常生活中合金的使用范围远大于纯金属 |
分析 A.甲醛易溶于水;
B.硅胶具有吸附能力;
C.光导纤维的主要材料为二氧化硅;
D.合金具有优良的机械性能,应用广泛.
解答 解:A.甲醛易溶于水,则新买的衣服可先用水清洗,故A正确;
B.硅胶具有吸附能力,且无毒,可用作袋装食品的干燥剂,故B正确;
C.光导纤维的主要材料为二氧化硅,不是高分子化合物,故C错误;
D.合金具有优良的机械性能,应用广泛,则使用范围远大于纯金属,故D正确.
故选C.
点评 本题考查物质的性质及应用,为高频考点,侧重于分析与应用能力的考查,注意把握物质的性质、环境保护、化学与生活的关系为解答该题的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.分子式为C8H8的有机物X,X核磁共振氢谱显示只有一个吸收峰,下列相关说法正确的是( )
| A. | X是乙烯 | B. | X能使溴水褪色 | ||
| C. | X属于不饱和烃 | D. | X的二氯代物有三种 |
13.用下列图示操作,装置正确且能达到实验目的是( )
| A. |  制取氨气 | B. |  干燥氯气 | C. |  转移溶液 | D. |  萃取溴 |
10.下列与化学有关的说法中正确的是( )
| A. | 在0.1mol/lHNO3溶液中加入FeCO3粉末,发生反应的离子方程式为:2FeCO3+2H+═2Fe2++CO2↑+H2O | |
| B. | 在$\frac{c(O{H}^{-})}{c({H}^{+})}$=1010的溶液中NO3-、I-、Na+、SO42-不能大量共存 | |
| C. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1 NA | |
| D. | 闭容器中2molNO与1molO2充分反应,产物的分子数小于2NA |
17. (1)基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(1)基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(2)金属锂氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
M是Mg(填元素符号).
(3)Cu2+基态的电子排布式为1s22s22p63s23p63d9sp3;向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4•H2O晶体,硫酸根离子中硫原子的杂化方式为sp3;不考虑空间构型,其内界结构可用示意图表示为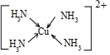 .
.
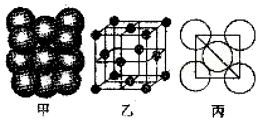
(4)某单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示,若已知该原子半径为d,NA表示阿伏伽德罗常数.摩尔质量为M,则该原子的配位数为12,该晶体的密度可表示为$\frac{{M}_{r}}{4\sqrt{2}(d×1{0}^{-10})^{3}{N}_{A}}$.
 (1)基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(1)基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.(2)金属锂氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)Cu2+基态的电子排布式为1s22s22p63s23p63d9sp3;向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4•H2O晶体,硫酸根离子中硫原子的杂化方式为sp3;不考虑空间构型,其内界结构可用示意图表示为
 .
.(4)某单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示,若已知该原子半径为d,NA表示阿伏伽德罗常数.摩尔质量为M,则该原子的配位数为12,该晶体的密度可表示为$\frac{{M}_{r}}{4\sqrt{2}(d×1{0}^{-10})^{3}{N}_{A}}$.
14.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
| 操 作 | 现 象 | 结 论 | |
| A | 滴加稀NaOH溶液,将红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| B | 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42- |
| C | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| A. | A | B. | B | C. | C | D. | D |
11.常温下,下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 将浓度均为0.10mol•L-1的CH3COONH4与CH3COONa溶液等体积混合:c(CH3COO-)>c(Na+)>c(NH4+)>c(OH-) | |
| B. | 向0.10mol•L-1CH3COONa溶液中滴加盐酸至溶液呈中性:c(Cl-)>c(Na+)>c(H+)=c(OH-) | |
| C. | 将0.10mol•L-1KHC2O4和0.10mol•L-1K2C2O4溶液等体积混合所得溶液中:2c(K+)=3c(C2O42-)+3c(HCO4) | |
| D. | 将等物质的量浓度的NH4HCO3与NaCl溶液等体积混合,析出部分NaHCO3晶体后的溶液(pH<7)中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3•H2O) |
18.下列实验装置错误的是( )
| A. |  实验室制备NO | B. |  实验室制取NH3 | ||
| C. |  收集SO2并验证其还原性 | D. |  验证铜绿受热分解的酸性气体产物 |

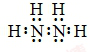 ;N2H4在水中的第一步电离方程式为N2H4+H2O?N2H5++OH-
;N2H4在水中的第一步电离方程式为N2H4+H2O?N2H5++OH-