题目内容
16.200℃时CO2和水蒸气的混合气体共23.2g与足量的Na2O2充分反应后,固体质量增加了7.2g,则原混合气体的总物质的量为( )| A. | 0.2mol | B. | 0.6mol | C. | 0.8mol | D. | l.0mol |
分析 向足量的固体Na2O2中通入23.2gCO2和H2O,发生反应:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,固体只增加了7.2g,是因为生成O2,根据质量守恒定律可知m(O2)=23.2g-7.2g=16g,根据n=$\frac{m}{M}$计算生成氧气的物质的量,根据方程式可知n(混合气体)=2n(O2).
解答 解:向足量的固体Na2O2中通入23.2gCO2和H2O,发生反应:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,固体只增加了7.2g,是因为生成O2,根据质量守恒定律可知m(O2)=23.2g-7.2g=16g,所以n(O2)=$\frac{16g}{32g/mol}$=0.5mol,
根据方程式可知n(混合气体)=2n(O2)=2×0.5mol=1mol,
故选:D.
点评 本题考查混合物的有关计算、过氧化钠的性质等,注意理解固体质量变化的原因,根据反应的方程式计算,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6. 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )| ①中的物质 | ②中的物质 | 预测①的现象 | |
| A | 酚酞溶液 | 浓盐酸 | 无明显现象 |
| B | 淀粉KI溶液 | 浓硝酸 | 无明显现象 |
| C | AlCl3溶液 | 浓氨水 | 有白色沉淀 |
| D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
| A. | A | B. | B | C. | C | D. | D |
7.下列化合物分子的核磁共振氢谱中氢原子的吸收峰只有一种的是( )
| A. | CH3OCH3 | B. | CH3CH2OH | C. | CH3CH2CH3 | D. | CH3COCH2CH3 |
4.某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应:
实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色.
探究1:白色沉淀产生的原因.
(1)白色沉淀是BaSO4.
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2.
①支持甲同学观点的实验证据是液面上方略显浅棕色.
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式3Ba2++2NO3-+3SO2+2H2O=3BaSO4↓+2NO+4H+.
③乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
探究2:在氧化SO2的过程中,NO3-和O2哪种微粒起到了主要作用.
(3)图1,在无氧条件下,BaCl2溶液pH下降的原因是SO2+H2O?H2SO3,H2SO3?HSO3-+H+.
(4)图2,BaCl2溶液中发生反应的离子方程式为2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+.
(5)依据上述图象你得出的结论是在氧化SO2的过程中,O2起了主要作用,说明理由在BaCl2溶液中起氧化作用的是O2,在Ba(NO3)2溶液中起氧化作用的是O2和NO3-,而图2中,分别向BaCl2、Ba(NO3)2溶液中通入SO2,pH变化趋势、幅度接近,因此起氧化作用的主要是O2.
实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色.
探究1:白色沉淀产生的原因.
(1)白色沉淀是BaSO4.
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2.
①支持甲同学观点的实验证据是液面上方略显浅棕色.
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式3Ba2++2NO3-+3SO2+2H2O=3BaSO4↓+2NO+4H+.
③乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
| 实验操作 | 实验现象 |
向2mL0.1mol/LBaCl2 溶液(填化学式)中通入SO2 | 试管内有白色沉淀产生 |
| 实验操作 | 实验数据 |
| 向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 | 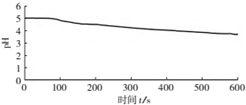 图1:向BaCl2(无氧)溶液中通入SO2 |
| 向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线. | 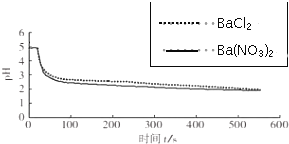 图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2 |
(4)图2,BaCl2溶液中发生反应的离子方程式为2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+.
(5)依据上述图象你得出的结论是在氧化SO2的过程中,O2起了主要作用,说明理由在BaCl2溶液中起氧化作用的是O2,在Ba(NO3)2溶液中起氧化作用的是O2和NO3-,而图2中,分别向BaCl2、Ba(NO3)2溶液中通入SO2,pH变化趋势、幅度接近,因此起氧化作用的主要是O2.
11.关于氟、钠、镁、氯四种元素的性质递变规律,描述正确的是( )
| A. | 原子半径:Na<Cl | B. | 热稳定性:HCI<HF | ||
| C. | 离子半径:F-<Mg2+ | D. | 碱性:NaOH<Mg(OH)2 |
1. 在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)?CO2(g)+H2(g)△H<O,CO和H2O浓度变化如图,则
在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)?CO2(g)+H2(g)△H<O,CO和H2O浓度变化如图,则
(1)0~4min CO的平均反应速率v(CO)=0.03mol/(L.min).
(2)达平衡时CO的转化率为60%,T1℃时该反应的平衡常数K=1.
(3)T2℃(高于T1℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
①表中3~4min时,反应v正=v逆(填“>”、“<”或“=”); C1>0.08mol/L(填“>”、“<”或“=”).
②4~5min时,平衡向逆反应方向移动,可能的原因是d(填字母).
a.增加水蒸气 b.降低温度
c.增大了CO2浓度 d.增加了氢气浓度.
 在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)?CO2(g)+H2(g)△H<O,CO和H2O浓度变化如图,则
在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)?CO2(g)+H2(g)△H<O,CO和H2O浓度变化如图,则(1)0~4min CO的平均反应速率v(CO)=0.03mol/(L.min).
(2)达平衡时CO的转化率为60%,T1℃时该反应的平衡常数K=1.
(3)T2℃(高于T1℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | C4 |
②4~5min时,平衡向逆反应方向移动,可能的原因是d(填字母).
a.增加水蒸气 b.降低温度
c.增大了CO2浓度 d.增加了氢气浓度.
8.下列说法正确的是( )
| A. | 1 mol强酸和1 mol强碱完全反应所放出的热量称为中和热 | |
| B. | 热化学方程式中表明的热量是指每摩尔反应物反应时吸收或放出的热量 | |
| C. | 1 mol碳燃烧所放出的热量为燃烧热 | |
| D. | 热化学方程式中的化学计量数表示物质的量,因此可用分数表示 |
5.A、B、C、D、E是元素周期表中前18号元素,原子序数依次增大,他们可组成离子化合物C2B和共价化合物DB3、AE4,已知B、D同主族,C、D、E同周期.下列说法不正确的是( )
| A. | 原子半径C>D>E | |
| B. | A2E6分子中各原子均满足8电子结构 | |
| C. | 气态氢化物的稳定性HmE>HnD | |
| D. | B、C形成的化合物中只可能存在离子键 |
14.某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是( )
| A. | 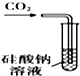 甲装置:可用来证明碳酸的酸性比硅酸强 | |
| B. | 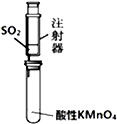 乙装置:可用来检验二氧化硫气体 | |
| C. | 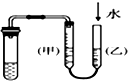 丙装置:用图示的方法不能检查此装置的气密性 | |
| D. |  丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集氢气 |