题目内容
7.下列化合物分子的核磁共振氢谱中氢原子的吸收峰只有一种的是( )| A. | CH3OCH3 | B. | CH3CH2OH | C. | CH3CH2CH3 | D. | CH3COCH2CH3 |
分析 核磁共振氢谱中有几个不同的峰,分子中就有几种H原子,有机物中只有一个吸收峰,说明分子中只有一种H原子.
解答 解:A.CH3OCH3分子中有1种氢原子,核磁共振氢谱有1个峰,故A正确;
B.CH3CH2OH分子中有3种氢原子,核磁共振氢谱有3个峰,故B错误;
C.CH3CH2CH3分子中有2种氢原子,核磁共振氢谱有2个峰,故C错误;
D.CH3COCH2CH3分子中有3种氢原子,核磁共振氢谱有3个峰,故D错误.
故选A.
点评 本题考查核磁共振氢谱与有机物中氢原子的种类关系,题目难度不大,核磁共振氢谱中峰值数等于有机物中氢原子的种类数.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列实验方法或操作能达到实验目的是( )
| A. | 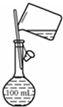 配制150mL 0.1 mol/L盐酸 | B. |  验证氨水呈碱性 | ||
| C. | 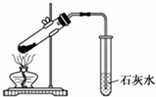 探究NaHCO3的热稳定性 | D. | 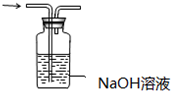 除去二氧化碳中的氯化氢 |
18.化学与日常生活紧密相关.下列说法中,不正确的是( )
| A. | 甲醛可作食品防腐剂 | B. | 氢氧化铝可作抗酸药 | ||
| C. | 氯化钠可作食品调味剂 | D. | 生石灰可作食品干燥剂 |
2. 汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.
汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.
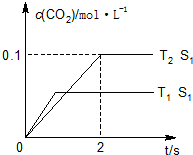
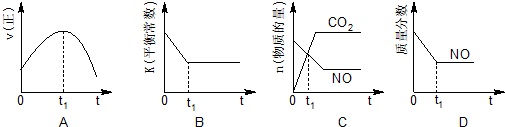
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的△H<0(填“>”“<”).
②在T2温度下,0~2s内的平均反应速率v(N2)=0.025mol/(L•s).
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)和H2O(g)的热化学方程式CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)已知反应:CO2(g)+H2(g)?CO(g)+H2O(g),现将不同量的CO2(g)和H2(g)分别通入到容积为2L的恒容密闭容器中进行反应,得到如下两组数据:
①实验1条件下平衡常数K=4.57(保留小数点后二位).
②该反应的△H>0(填“<”或“>”).
 汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.
汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的△H<0(填“>”“<”).
②在T2温度下,0~2s内的平均反应速率v(N2)=0.025mol/(L•s).
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)和H2O(g)的热化学方程式CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)已知反应:CO2(g)+H2(g)?CO(g)+H2O(g),现将不同量的CO2(g)和H2(g)分别通入到容积为2L的恒容密闭容器中进行反应,得到如下两组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| CO2(g) | H2(g) | H2O(g) | CO2(g) | |||
| 1 | 650 | 2 | 1 | 0.4 | 1.6 | 6 |
| 2 | 900 | 4 | 2 | 1.6 | 2.4 | 2 |
②该反应的△H>0(填“<”或“>”).
12.用丙醛(CH3CH2CHO)制取聚丙烯的过程中发生的反应类型为( )
①取代反应
②消去反应
③加聚反应
④氧化反应
⑤还原反应.
①取代反应
②消去反应
③加聚反应
④氧化反应
⑤还原反应.
| A. | ⑤②③ | B. | ④②③ | C. | ⑤②④ | D. | ①②③ |
19.下列说法不正确的是( )
| A. | 室温下,在水中的溶解度:乙二醇>乙醇>苯酚 | |
| B. | 用质谱法可确定有机物分子中的官能团 | |
| C. | 用核磁共振氢谱能够区分CH3CH2CHO和CH3COCH3 | |
| D. | 乙二酸、甲醛、苯乙烯均可发生聚合反应 |
16.200℃时CO2和水蒸气的混合气体共23.2g与足量的Na2O2充分反应后,固体质量增加了7.2g,则原混合气体的总物质的量为( )
| A. | 0.2mol | B. | 0.6mol | C. | 0.8mol | D. | l.0mol |
17.某反应过程中体系的能量变化如图所示,下列说法中错误的是( )


| A. | 反应物的键能总和比生成物的键能总和高 | |
| B. | E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 | |
| C. | 正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应 | |
| D. | 使用合适的催化剂能同时降低E1和E2 |
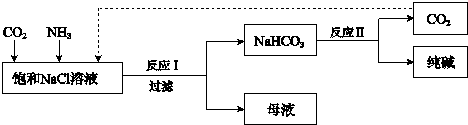
 2NH3.
2NH3.