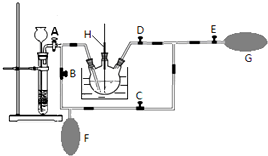
题目内容
8.下列说法正确的是( )| A. | 1 mol强酸和1 mol强碱完全反应所放出的热量称为中和热 | |
| B. | 热化学方程式中表明的热量是指每摩尔反应物反应时吸收或放出的热量 | |
| C. | 1 mol碳燃烧所放出的热量为燃烧热 | |
| D. | 热化学方程式中的化学计量数表示物质的量,因此可用分数表示 |
分析 A、中和热是指稀的强酸和稀的强碱发生反应生成1mol水放出的热量;
B、热化学方程式中物质的计量数不一定为1;
C、燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量;
D、热化学方程式中的化学计量数只表示物质的量,不表示分子数.
解答 解:A、在稀溶液中,稀的强酸跟强碱发生中和反应而生成1mo水,这时的反应热叫做中和热,如1 mol强酸和1 mol强碱完全反应所放出的热量不一定等于中和热,如1mol硫酸与1mol氢氧化钡反应生成2mol水,反应热不是中和热,故A错误;
B、热化学方程式中物质的计量数不一定为1,热化学方程式中表明的热量不是指每摩尔反应物反应时吸收或放出的热量,故B错误;
C、燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,1 mol碳完全燃烧生成二氧化碳时所放出的热量为燃烧热,故C错误;
D、热化学方程式中的化学计量数只表示物质的量,不表示分子数,所以可用分数或小数表示,故D正确;
故选D.
点评 本题考查了热化学方程式的含义、燃烧热和中和热的概念,题目难度不大,侧重于基础知识的考查.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
18.化学与日常生活紧密相关.下列说法中,不正确的是( )
| A. | 甲醛可作食品防腐剂 | B. | 氢氧化铝可作抗酸药 | ||
| C. | 氯化钠可作食品调味剂 | D. | 生石灰可作食品干燥剂 |
19.下列说法不正确的是( )
| A. | 室温下,在水中的溶解度:乙二醇>乙醇>苯酚 | |
| B. | 用质谱法可确定有机物分子中的官能团 | |
| C. | 用核磁共振氢谱能够区分CH3CH2CHO和CH3COCH3 | |
| D. | 乙二酸、甲醛、苯乙烯均可发生聚合反应 |
16.200℃时CO2和水蒸气的混合气体共23.2g与足量的Na2O2充分反应后,固体质量增加了7.2g,则原混合气体的总物质的量为( )
| A. | 0.2mol | B. | 0.6mol | C. | 0.8mol | D. | l.0mol |
3.下列有关电解的说法正确的是( )
| A. | 惰性电极电解硝酸银溶液不可能在电极上生成银,因为银可以溶于硝酸 | |
| B. | 25℃,惰性电极电解氢氧化钠溶液,溶液PH不变,因为实质是电解水 | |
| C. | 惰性电极电解足量硫酸铜溶液一段时间加入氧化铜固体可使电解质恢复到电解前 | |
| D. | 惰性电极电解淀粉碘化钾溶液,可看到阴极区域溶液变蓝 |
20.某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、Na2SO4、FeO、Fe2O3中的若干种,某同学为确定该固体粉末的成分,取甲进行连续实验,实验过程及现象如下:
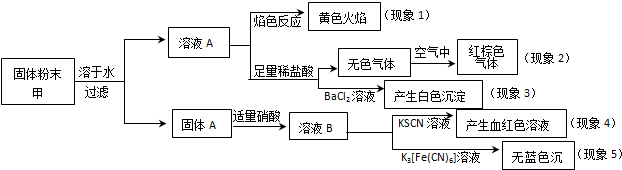
该同学得出的结论正确的是( )

该同学得出的结论正确的是( )
| A. | 根据现象1可推出该固体粉末中含有钠元素,但一定不含钾元素 | |
| B. | 根据现象2可推出该固体粉末中一定不含有NaNO2 | |
| C. | 根据现象3可推出该固体粉末中一定含有Na2SO4 | |
| D. | 根据现象4和现象5可推出该固体粉末中一定不含FeO |
17.某反应过程中体系的能量变化如图所示,下列说法中错误的是( )


| A. | 反应物的键能总和比生成物的键能总和高 | |
| B. | E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 | |
| C. | 正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应 | |
| D. | 使用合适的催化剂能同时降低E1和E2 |
6.已知热化学方程式:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ•mol-1,在容器中充入2mol SO2和1mol O2,充分反应,最终放出的热量( )
| A. | =196.64kJ | B. | =98.32kJ | C. | <196.64kJ | D. | >196.64kJ |