题目内容
6.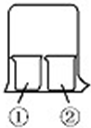 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )| ①中的物质 | ②中的物质 | 预测①的现象 | |
| A | 酚酞溶液 | 浓盐酸 | 无明显现象 |
| B | 淀粉KI溶液 | 浓硝酸 | 无明显现象 |
| C | AlCl3溶液 | 浓氨水 | 有白色沉淀 |
| D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.浓盐酸具有挥发性,酚酞溶液在酸性条件下为无色;
B.硝酸具有挥发性、强氧化性,可以将KI氧化为I2,I2遇淀粉变蓝色;
C.浓氨水具有挥发性,氨水与氯化铝反应生成氢氧化铝;
D.饱和氯水挥发出氯气,氯气与水反应生成HClO,HClO具有漂白性.
解答 解:A.浓盐酸具有挥发性,挥发出的HCl进入酚酞溶液,酚酞溶液在酸性条件下不变色,故A正确;
B.硝酸具有挥发性,挥发出的硝酸进入淀粉KI溶液,硝酸具有强氧化性,可以将KI氧化为I2,I2遇淀粉变蓝色,故B错误;
C.浓氨水具有挥发性,挥发出的氨气,溶于氯化铝溶液,一水合氨与氯化铝反应生成氢氧化铝白色沉淀,故C正确;
D.饱和氯水挥发出氯气,氯气与湿润红纸条接触,氯气水反应生成HClO,HClO具有漂白性,使湿润红纸条褪色,故D正确.
故选B.
点评 本题考查化学实验方案的评价,涉及化学实验、元素化合物性质等,难度不大,明确元素化合物的性质即可分析解答本题,注意“烟”和“雾”的区别.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.有一类组成最简单的有机硅化合物叫硅烷,它的分子结构与烷烃相似.下列有关说法错误的是( )
| A. | 相同条件下,硅甲烷的密度小于甲烷 | |
| B. | 硅甲烷燃烧生成二氧化硅和水 | |
| C. | 硅烷的分子通式可表示为SinH2n+2 | |
| D. | 硅甲烷与硅乙烷的相对分子质量相差30 |
17.下列实验方法或操作能达到实验目的是( )
| A. | 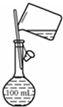 配制150mL 0.1 mol/L盐酸 | B. |  验证氨水呈碱性 | ||
| C. | 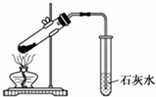 探究NaHCO3的热稳定性 | D. | 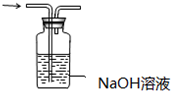 除去二氧化碳中的氯化氢 |
1.当光线通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 稀盐酸 | B. | CuSO4溶液 | C. | 酒精溶液 | D. | Fe(OH)3胶体 |
11.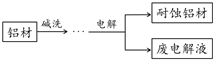 铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( )
铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( )
 铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( )
铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( )| A. | 碱洗目的是除去铝材表面的自然氧化膜:2OH-+Al2O3═2AlO2-+H2O | |
| B. | 碱洗时铝材表面会出现气泡:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 获得耐蚀铝材的电极反应为:4Al-12e-+3O2═2Al2O3 | |
| D. | 用稀氨水洗去耐蚀铝材表面的酸:NH3•H2O+H+═NH4++H2O |
18.化学与日常生活紧密相关.下列说法中,不正确的是( )
| A. | 甲醛可作食品防腐剂 | B. | 氢氧化铝可作抗酸药 | ||
| C. | 氯化钠可作食品调味剂 | D. | 生石灰可作食品干燥剂 |
16.200℃时CO2和水蒸气的混合气体共23.2g与足量的Na2O2充分反应后,固体质量增加了7.2g,则原混合气体的总物质的量为( )
| A. | 0.2mol | B. | 0.6mol | C. | 0.8mol | D. | l.0mol |
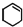 )为原料合成,路线如下(部分反应条件略):
)为原料合成,路线如下(部分反应条件略):



 .
. .
.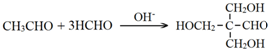 .
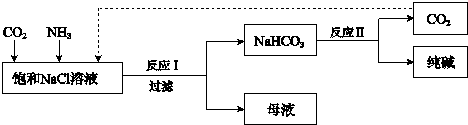
.
 2NH3.
2NH3.