题目内容
11.关于氟、钠、镁、氯四种元素的性质递变规律,描述正确的是( )| A. | 原子半径:Na<Cl | B. | 热稳定性:HCI<HF | ||
| C. | 离子半径:F-<Mg2+ | D. | 碱性:NaOH<Mg(OH)2 |
分析 A、同周期从左到右原子半径逐渐减小;
B、根据离子的电子排布分析;
C、元素的非金属性越强,则氢化物的稳定性越强;
D、元素的金属性越强,对应最高价氧化物水化物的碱性越强.
解答 解:A、同周期从左到右原子半径逐渐减小,则原子半径:Na>Cl,故A错误;
B、非金属性:F>Cl,元素的非金属性越强,则氢化物的稳定性越强,所以热稳定性:HF>HCl,故B正确;
C、F-和Mg2+的核外电子排布相同,核电荷数越大的,半径越小,故F->Mg2+,故C错误;
D、元素的金属:Na>Mg,金属性越强,对应最高价氧化物水化物的碱性越强,则碱性:NaOH>Mg(OH)2,故D错误;
故选B.
点评 本题考查了元素周期律,熟悉非金属元素和金属元素的性质变化规律及非金属性的比较方法即可解答,难度不大.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
1.当光线通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 稀盐酸 | B. | CuSO4溶液 | C. | 酒精溶液 | D. | Fe(OH)3胶体 |
2.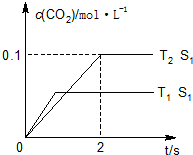 汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.
汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的△H<0(填“>”“<”).
②在T2温度下,0~2s内的平均反应速率v(N2)=0.025mol/(L•s).
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
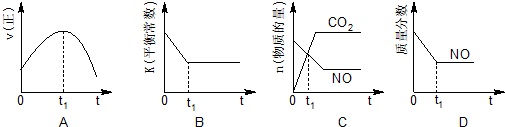
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)和H2O(g)的热化学方程式CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)已知反应:CO2(g)+H2(g)?CO(g)+H2O(g),现将不同量的CO2(g)和H2(g)分别通入到容积为2L的恒容密闭容器中进行反应,得到如下两组数据:
①实验1条件下平衡常数K=4.57(保留小数点后二位).
②该反应的△H>0(填“<”或“>”).
 汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.
汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的△H<0(填“>”“<”).
②在T2温度下,0~2s内的平均反应速率v(N2)=0.025mol/(L•s).
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)和H2O(g)的热化学方程式CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)已知反应:CO2(g)+H2(g)?CO(g)+H2O(g),现将不同量的CO2(g)和H2(g)分别通入到容积为2L的恒容密闭容器中进行反应,得到如下两组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| CO2(g) | H2(g) | H2O(g) | CO2(g) | |||
| 1 | 650 | 2 | 1 | 0.4 | 1.6 | 6 |
| 2 | 900 | 4 | 2 | 1.6 | 2.4 | 2 |
②该反应的△H>0(填“<”或“>”).
19.下列说法不正确的是( )
| A. | 室温下,在水中的溶解度:乙二醇>乙醇>苯酚 | |
| B. | 用质谱法可确定有机物分子中的官能团 | |
| C. | 用核磁共振氢谱能够区分CH3CH2CHO和CH3COCH3 | |
| D. | 乙二酸、甲醛、苯乙烯均可发生聚合反应 |
6.下列物质(或主要成分)对应的化学式中,不正确的是( )
| A. | 小苏打NaHCO3 | B. | 烧碱NaOH | C. | 绿矾FeSO4•7H2O | D. | 钡餐BaCO3 |
16.200℃时CO2和水蒸气的混合气体共23.2g与足量的Na2O2充分反应后,固体质量增加了7.2g,则原混合气体的总物质的量为( )
| A. | 0.2mol | B. | 0.6mol | C. | 0.8mol | D. | l.0mol |
3.下列有关电解的说法正确的是( )
| A. | 惰性电极电解硝酸银溶液不可能在电极上生成银,因为银可以溶于硝酸 | |
| B. | 25℃,惰性电极电解氢氧化钠溶液,溶液PH不变,因为实质是电解水 | |
| C. | 惰性电极电解足量硫酸铜溶液一段时间加入氧化铜固体可使电解质恢复到电解前 | |
| D. | 惰性电极电解淀粉碘化钾溶液,可看到阴极区域溶液变蓝 |
20.某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、Na2SO4、FeO、Fe2O3中的若干种,某同学为确定该固体粉末的成分,取甲进行连续实验,实验过程及现象如下:
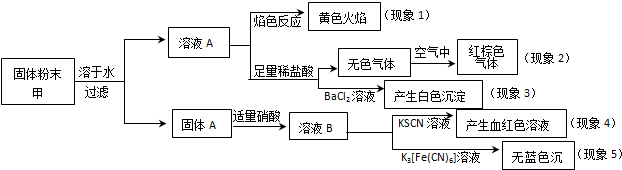
该同学得出的结论正确的是( )

该同学得出的结论正确的是( )
| A. | 根据现象1可推出该固体粉末中含有钠元素,但一定不含钾元素 | |
| B. | 根据现象2可推出该固体粉末中一定不含有NaNO2 | |
| C. | 根据现象3可推出该固体粉末中一定含有Na2SO4 | |
| D. | 根据现象4和现象5可推出该固体粉末中一定不含FeO |
9.NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,2.24LNO2分子总数小于0.1NA | |
| B. | 50ml,18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| D. | 6.8g液态KHSO4中含有0.1NA个阳离子 |