题目内容
10.一定温度下容积恒定的密闭容器中,有可逆反应:2NO2(g)?N2O4(g).当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )①混合气体的密度 ②容器内气体的压强 ③混合气体的颜色 ④NO2物质的量浓度.
| A. | ①和④ | B. | ②和③ | C. | ②③④ | D. | 只有④ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①容积恒定的密闭容器中,混合气体的密度是一个不变的值,故错误;
②容器内气体的压强不变,说明气体的物质的量不变,反应达平衡状态,故正确;
③混合气体的颜色不变,说明二氧化氮的浓度不变,正逆反应速率相等,达平衡状态,故正确;
④NO2物质的量浓度不变,正逆反应速率相等,达平衡状态,故正确;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
5.化学与生产、生活息息相关,下列叙述正确的是( )
| A. | 使用催化剂能够降低化学反应的反应热(△H) | |
| B. | 点燃爆竹后,硫燃烧生成SO3 | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附 |
1.有甲、乙、丙三种溶液,进行如下操作:Na2CO3溶液$\stackrel{甲}{→}$白色沉淀$\stackrel{过量乙}{→}$沉淀溶解丙产生气体$\stackrel{丙}{→}$产生白色沉淀
则甲、乙、丙三种溶液中溶质可能是( )
则甲、乙、丙三种溶液中溶质可能是( )
| A. | BaCl2、H2SO4、MgCl2 | B. | CaCl2、HNO3、AgNO3 | ||
| C. | CaCl2、HNO3、NaCl | D. | BaCl2、HCl、NaCl |
18.下列溶液中的氯离子数与50mL 1mol/L的AlCl3溶液中氯离子数目相等的是( )
| A. | 150 mL 1 mol•L-1的NaCl | B. | 75 mL 1.5mol•L-1的CaCl2 | ||
| C. | 150 mL 3 mol•L-1的KCl | D. | 75 mL 2 mol•L-1的NH4Cl |
5.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 在常温常压下,11.2 LN2含有的分子数为0.5 NA | |
| B. | 71gCl2所含原子数为NA | |
| C. | 在常温常压下,1molNe含有的原子数为NA | |
| D. | 在同温、同压下,相同体积的任何气体单质所含的原子数相同 |
15.某温度下,已知反应mX(g)+nY(g)?qZ(g)△H>0,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是( )
| A. | 反应速率v正(X)=$\frac{m}{n}$ v逆(Y) | B. | 降低温度,c$\frac{c(Y)}{c(Z)}$的值变小 | ||
| C. | 增加Y的物质的量,X的转化率增大 | D. | 加入X,反应的△H增大 |
2.下列反应的离子方程式正确的是( )
| A. | 氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O | |
| C. | 向苯酚钠溶液中通入少量CO2: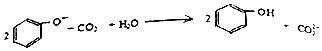 | |
| D. | 等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O |
19.下列有关化学反应中的能量变化的叙述正确的是( )
| A. | 化学反应的能量变化只表现为反应放热或吸热两种形式 | |
| B. | 一个反应的反应物总能量大于生成物总能量,则该反应的焓变一定小于零 | |
| C. | 燃烧热的大小与热化学方程式中可燃物计量系数成正比 | |
| D. | 含1mol硫酸的稀溶液与足量NaOH稀溶液反应生成水所放出的热量为中和热 |
20.将Cl2通入0.05mol/L H2S溶液中,刚好硫全部析出,此时溶液的PH为( )
| A. | 0.1 | B. | 3 | C. | 2 | D. | 1 |