题目内容
1.有甲、乙、丙三种溶液,进行如下操作:Na2CO3溶液$\stackrel{甲}{→}$白色沉淀$\stackrel{过量乙}{→}$沉淀溶解丙产生气体$\stackrel{丙}{→}$产生白色沉淀则甲、乙、丙三种溶液中溶质可能是( )
| A. | BaCl2、H2SO4、MgCl2 | B. | CaCl2、HNO3、AgNO3 | ||
| C. | CaCl2、HNO3、NaCl | D. | BaCl2、HCl、NaCl |
分析 由Na2CO3溶液$\stackrel{甲}{→}$白色沉淀$\stackrel{过量乙}{→}$沉淀溶解丙产生气体$\stackrel{丙}{→}$产生白色沉淀可知,加甲生成的白色沉淀与酸反应生成气体和沉淀,则甲中含钡离子或钙离子,乙为酸,后来沉淀为硫酸钡或硝酸银,以此来解答.
解答 解:A.由Na2CO3溶液$\stackrel{BaCl_{2}}{→}$BaCO3$\stackrel{过量H_{2}SO_{4}}{→}$沉淀溶解并产生气体,但不符合$\stackrel{丙}{→}$产生白色沉淀,故A不选;
B.由Na2CO3溶液$\stackrel{CaCl_{2}}{→}$CaCO3$\stackrel{过量HNO_{3}}{→}$沉淀溶解并产生气体$\stackrel{AgNO_{3}}{→}$产生AgCl白色沉淀,故B选;
C.由Na2CO3溶液$\stackrel{CaCl_{2}}{→}$CaCO3$\stackrel{过量HNO_{3}}{→}$沉淀溶解并产生气体$\stackrel{NaCl}{→}$不反应,故C不选;
D.由Na2CO3溶液$\stackrel{BaCl_{2}}{→}$BaCO3$\stackrel{HCl}{→}$沉淀溶解并产生气体$\stackrel{NaCl}{→}$不反应,故D不选.
故选B.
点评 本题考查无机物的推断,为高频考点,综合考查元素化合物知识,把握转化中沉淀溶解时乙为酸,而后来沉淀应为硫酸钡或氯化银为解答的关键,侧重分析能力及知识综合应用能力的考查,题目难度不大.

练习册系列答案
相关题目
16.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,可以通过出现浑浊的快慢来判断反应的快慢程度,下列各组实验中最先出现浑浊的是( )
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | ||
| A | 25 | 5 | 0.1 | 20 | 0.1 |
| B | 25 | 5 | 0.2 | 10 | 0.2 |
| C | 35 | 5 | 0.1 | 20 | 0.1 |
| D | 35 | 5 | 0.2 | 10 | 0.2 |
| A. | A | B. | B | C. | C | D. | D |
17.近年来,全国安全事故频发,折射出人们对化学品与安全知识的极度缺乏,下列有关化学品与安全的说法或操作错误的是( )
| A. | A.运石油的油罐车上应贴  标志,并由专人押运 标志,并由专人押运 | |
| B. | 不慎将酒精洒到桌面上引起着火,可用水扑灭 | |
| C. | 氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用硼酸稀溶液冲洗 | |
| D. | 右图装置可分离CH3COOC2H5和碳酸钠饱和溶液 |
9.人体中发生的以下变化属于物理变化的是( )
| A. | 汗水的挥发 | B. | 蛋白质的水解 | C. | 葡萄糖的氧化 | D. | 油脂的消化吸收 |
16.下列物质反应后一定有+3价铁生成的是( )
①过量的Fe与Cl2加热时发生反应
②Fe与过量稀H2SO4反应后,再向其中加KNO3
③Fe与过量的S加热时发生反应
④Fe(NO3)2溶液中加少量盐酸
⑤Fe和Fe2O3的混合物溶于盐酸中.
①过量的Fe与Cl2加热时发生反应
②Fe与过量稀H2SO4反应后,再向其中加KNO3
③Fe与过量的S加热时发生反应
④Fe(NO3)2溶液中加少量盐酸
⑤Fe和Fe2O3的混合物溶于盐酸中.
| A. | ①②③ | B. | ②④⑤ | C. | ①④⑤ | D. | ①②④ |
13.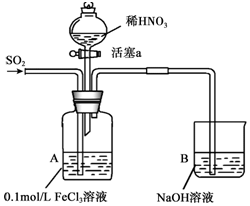 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
实验记录如表:
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学方程式和简单文字叙述):Fe3++3H2O?Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为:Fe3++6SO2?Fe(SO2)63+.请用化学平衡移动原理解释实验I中溶液颜色变化的原因Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2?Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
(3)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(4)实验III中,浅绿色溶液变为黄色的原因是(用离子方程式表示)3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是2NO+O2=2NO2.
(6)综合上述实验得出的结论是:在酸性条件下,NO3-、SO42-、Fe3+三种微粒的氧化性由强到弱的顺序是:NO3->Fe3+>SO42-.
 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)实验记录如表:
| 实验序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液迅速变成深红棕色,最终变为浅绿色. |
| II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液. | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀. |
| III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a | A中浅绿色溶液最终变为黄色. |
| IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中通入空气. | 溶液变为红色;液面上方有少量红棕色气体生成. |
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学方程式和简单文字叙述):Fe3++3H2O?Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为:Fe3++6SO2?Fe(SO2)63+.请用化学平衡移动原理解释实验I中溶液颜色变化的原因Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2?Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
(3)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(4)实验III中,浅绿色溶液变为黄色的原因是(用离子方程式表示)3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是2NO+O2=2NO2.
(6)综合上述实验得出的结论是:在酸性条件下,NO3-、SO42-、Fe3+三种微粒的氧化性由强到弱的顺序是:NO3->Fe3+>SO42-.
10.一定温度下容积恒定的密闭容器中,有可逆反应:2NO2(g)?N2O4(g).当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体的颜色 ④NO2物质的量浓度.
①混合气体的密度 ②容器内气体的压强 ③混合气体的颜色 ④NO2物质的量浓度.
| A. | ①和④ | B. | ②和③ | C. | ②③④ | D. | 只有④ |
11.能正确表示下列反应的离子方程式是( )
| A. | 在H2SO4溶液中滴入Ba(OH)2溶液至溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| D. | 醋酸溶解鸡蛋壳:CaCO3+2H+═Ca2++H2O+CO2↑ |