题目内容
20.将Cl2通入0.05mol/L H2S溶液中,刚好硫全部析出,此时溶液的PH为( )| A. | 0.1 | B. | 3 | C. | 2 | D. | 1 |
分析 发生Cl2+H2S=2HCl+S↓,c(HCl)=2c(H2S),结合pH=-lgc(H+)计算.
解答 解:发生Cl2+H2S=2HCl+S↓,c(HCl)=2c(H2S)=0.05mol/L×2=0.1mol/L,pH=-lg0.1=1,
故选D.
点评 本题考查化学反应的计算,为高频考点,把握发生的反应及氢离子浓度为解答的关键,侧重分析与计算能力的考查,注意pH的计算公式,题目难度不大.

练习册系列答案
相关题目
10.一定温度下容积恒定的密闭容器中,有可逆反应:2NO2(g)?N2O4(g).当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体的颜色 ④NO2物质的量浓度.
①混合气体的密度 ②容器内气体的压强 ③混合气体的颜色 ④NO2物质的量浓度.
| A. | ①和④ | B. | ②和③ | C. | ②③④ | D. | 只有④ |
11.能正确表示下列反应的离子方程式是( )
| A. | 在H2SO4溶液中滴入Ba(OH)2溶液至溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| D. | 醋酸溶解鸡蛋壳:CaCO3+2H+═Ca2++H2O+CO2↑ |
8.设阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 含1molFeCl3溶液水解生成1molFe(OH)3胶体后生成NA个胶体粒子 | |
| B. | 分子数为NA的N2,CO混合气体体积为22.4L,质量为28g | |
| C. | 0.5molFeBr2与足量氯气反应转移的电子数为NA | |
| D. | 足量Zn与一定量的浓硫酸反应,产生22.4L标准状况气体时,转移的电子数为2NA |
15.下列各组试剂中.能用如图所示实验装置进行配备和收集气体的一组是( )
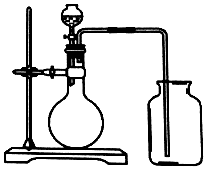

| A. | 锌和稀硫酸 | B. | 碳酸钙和硫酸 | ||
| C. | 过氧化氢和二氧化锰 | D. | 硫酸铵和氢氧化钠 |
12.2016年10月5日,法国、美国和荷兰三位科学家因在“分子机器设计合成”做出贡献而荣获该年度诺贝尔化学奖.他们利用原子、分子的组合,制作出了最小的分子马达和分子车.下列相关说法不正确的是( )
| A. | 化学家可以在微观层面上操纵分子和原子,组装分子材料 | |
| B. | 化学是一门具有创造性的科学,化学的特征就是认识分子和制造分子 | |
| C. | 化学是在原子、分子的水平上研究物质的一门自然科学 | |
| D. | 化学注重理论分析、推理,而不需要做化学实验 |
9.下列说法正确的是( )
①离子化合物一定含离子键,也可能含极性键或非极性键
②同位素的性质几乎完全相同
③水分子稳定性好是因水分子间含有氢键
④非金属单质中一定存在共价键
⑤由非金属元素组成的化合物一定是共价化合物
⑥化学反应中一定有化学键断裂,同时也有化学键形成
⑦盐酸中含有H+和Cl-,所以HCl是离子化合物( )
①离子化合物一定含离子键,也可能含极性键或非极性键
②同位素的性质几乎完全相同
③水分子稳定性好是因水分子间含有氢键
④非金属单质中一定存在共价键
⑤由非金属元素组成的化合物一定是共价化合物
⑥化学反应中一定有化学键断裂,同时也有化学键形成
⑦盐酸中含有H+和Cl-,所以HCl是离子化合物( )
| A. | ①③⑥⑦ | B. | ①②④③⑥ | C. | ①⑥⑦ | D. | ①⑥ |
10.化学与生产生活密切相关,下列说法正确的是( )
| A. | 镁铝合金粉末着火后可用干冰灭火器灭火 | |
| B. | 装潢涂料用苯作溶剂比用水作溶剂好 | |
| C. | 自来水中的亚硝胺超标会危害人体健康 | |
| D. | 提倡使用一次性筷子、纸杯等,更有利于保护环境 |