题目内容
15.某温度下,已知反应mX(g)+nY(g)?qZ(g)△H>0,m+n>q,在体积一定的密闭容器中达到平衡,下列叙述正确的是( )| A. | 反应速率v正(X)=$\frac{m}{n}$ v逆(Y) | B. | 降低温度,c$\frac{c(Y)}{c(Z)}$的值变小 | ||
| C. | 增加Y的物质的量,X的转化率增大 | D. | 加入X,反应的△H增大 |
分析 A、达到平衡时,正逆反应速率相等,且不同物质表示的反应速率之比等于方程式的系数之比;
B、降低温度,化学平衡向着放热方向进行;
C、增加反应物的物质的量,平衡正向移动;
D、一个固定化学反应的焓变只和反应物以及生成物的能量有关,和浓度以及物质的量的多少无关.
解答 解:A、X、Y表示的反应速率之比等于方程式的系数之比,且达到平衡时,正逆反应速率相等,即平衡时,v正(X)=$\frac{m}{n}$v逆(Y),故A正确;
B、降低温度,化学平衡向着放热方向进行,即向逆方向进行,$\frac{c(Y)}{c(Z)}$的值变大,故B错误;
C、增加Y的物质的量,平衡正向移动,X的转化率增大,故C正确;
D、加入X,反应的△H不会发生变化,故D错误.
故选AC.
点评 本题考查学生影响化学平衡移动的因素:温度、浓度、压强等,注意化学反应的焓变的影响因素,难度不大.

练习册系列答案
相关题目
10. NaClO2溶液中可能存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒.用稀H2SO4或NaOH溶液调整溶液pH,经测定,25℃时各组分含量随pH的变化情况如图所示(Cl-没有画出).则该温度下,下列分析不正确的是( )
NaClO2溶液中可能存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒.用稀H2SO4或NaOH溶液调整溶液pH,经测定,25℃时各组分含量随pH的变化情况如图所示(Cl-没有画出).则该温度下,下列分析不正确的是( )
 NaClO2溶液中可能存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒.用稀H2SO4或NaOH溶液调整溶液pH,经测定,25℃时各组分含量随pH的变化情况如图所示(Cl-没有画出).则该温度下,下列分析不正确的是( )
NaClO2溶液中可能存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒.用稀H2SO4或NaOH溶液调整溶液pH,经测定,25℃时各组分含量随pH的变化情况如图所示(Cl-没有画出).则该温度下,下列分析不正确的是( )| A. | NaClO2溶液呈碱性 | |
| B. | HClO2的电离平衡常数Ka=1.0×10-6 | |
| C. | pH=8的NaClO2溶液中:c(Na+)+c(H+)=c(ClO2-)+c(OH-) | |
| D. | pH=5时含氯元素的微粒浓度大小关系:c(HClO2)>c(ClO2-)>c(Cl-)>c(ClO2) |
10.一定温度下容积恒定的密闭容器中,有可逆反应:2NO2(g)?N2O4(g).当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体的颜色 ④NO2物质的量浓度.
①混合气体的密度 ②容器内气体的压强 ③混合气体的颜色 ④NO2物质的量浓度.
| A. | ①和④ | B. | ②和③ | C. | ②③④ | D. | 只有④ |
20.下列说法中错误的是( )
| A. | 从1 L 1 mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L | |
| B. | 10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% | |
| C. | 0.5 L 2 mol/L BaCl2溶液中,Ba2+和Cl-总数约为3×6.02×1023 | |
| D. | 配制0.5 L 10 mol/L的盐酸,需要标准状况下的氯化氢气体112 L |
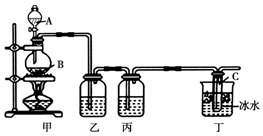 某化学活动小组欲用如图所示装置进行实验制取漂白液(次氯酸钠和氯化钠的混合溶液),并提高次氯酸钠含量.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.(据资料显示:Cl2和NaOH在不同温度下,产物不同.在较高温度下易生成NaClO3)试回答:
某化学活动小组欲用如图所示装置进行实验制取漂白液(次氯酸钠和氯化钠的混合溶液),并提高次氯酸钠含量.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.(据资料显示:Cl2和NaOH在不同温度下,产物不同.在较高温度下易生成NaClO3)试回答: