��Ŀ����
13���ߴ������������ȶ�������������ζ����ʳƷ��ҩƷ����ױƷ������ɫ���� ijʵ��С���ù�ҵFeCl3��Ʒ����Ca��Mn��Cu���������ӣ�Ϊԭ�ϣ�����ȡ��Y�����춡����ͪ����ȡ����ȡ�ߴ���������ʵ������е���Ҫ����������ͼ1��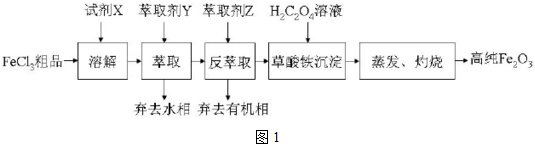
��֪���Լ�X��Ũ���ᣬHCl��Ũ��+FeCl3?HFeCl4
��ش��������⣺
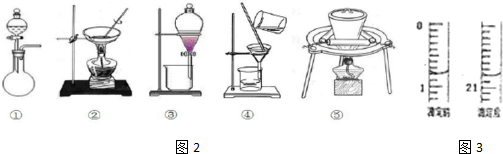
��1��������ʵ����������жϣ���ͼ2������ʵ��װ���У�û���õ����Ǣ٢ܣ�����ţ�
��2������ȡ��Y��ȡ�IJ����У�
��Ca��Mn��Cu���������Ӽ�������ˮ ���ˮ�����л��������У�
�ڷ�Һʱ��Ϊ��֤Һ��˳�����£�Ӧ�Ƚ���Һ©���ϵIJ�������ʹ���ϵİ��۶�©�����ϵ�С�ף��ٴ����������²�Һ����ȫ����ʱ���ر��������ٴ��Ͽڵ����ϲ�Һ�壮
��3���Ʊ���ȡ��Y�����춡����ͪ��ʱ����ֲ�Ʒ�к���������ͪ��4-��-2-�紼���������ʵ����ʣ�һ��ɲ����������ᴿ������ʱ��Ӧ���¶ȼ�ˮ��������������ƿ֧�ܿڴ�������ǰ��Ԥ�����ֲ�Ʒʱ����������Aϴ������ѡ�Լ���Ӧ����ĸ����ͬ��������Bϴ�������Aϴ��
A��ˮ B��̼��������Һ C���Ҵ�
��4�������Լ��У�����ȡ��Z�����ѡ����A������ȡ�ܷ�����ԭ���ǼӸߴ�ˮʱ�����[��c��H+��]���ͣ�HCl��Ũ��+FeCl3?HFeCl4ƽ����ת��ΪFeCl3�ķ����ƶ����ӻ�ѧƽ��ĽǶȽ��н��ͣ���
A���ߴ�ˮ B������ C��ϡ���� D���ƾ�
��5���ⶨ��Ʒ���������ĺ����辭���ܡ���ԭΪFe2+��Ȼ���������������ñ� K2Cr2O7��Һ�ζ�����ԭ������Cr3+�����ʲ���K2Cr2O7��Ӧ������ȷ��ȡWg��Ʒ�����ܡ���ԭΪFe2+����0.1000mol/L�ı���Һ���еζ���
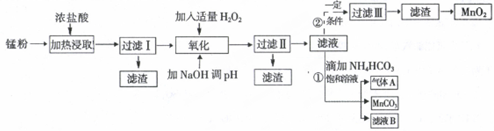
�ٵζ���ʼ���յ��Һ��λ����ͼ3��������K2Cr2O7����Һ���Ϊ20mL��
�ڲ�Ʒ���������ĺ���Ϊ$\frac{96}{W}$%��������λ��Ч���֣���
��6���ҹ����ڿƼ����顶����Сʶ•��ʯ�ࡷ���������෯�������̷���FeSO4•7H2O�����������ļ��أ����෯����Ѭ�ˣ��·���֮���ã���ľ��ʢ�����ݴ˷�����д�������෯���������Ļ�ѧ����ʽ��2FeSO4•7H2O$\frac{\underline{\;\;��\;\;}}{\;}$Fe2O3+SO2+SO3+7H2O��
���� FeCl3��Ʒ����Ũ���ᣬ�õ�����Fe3+��Ca2+��Mn2+��Cu2+�����ӵ���Һ������ȡ��Y�����춡����ͪ����ȡ�����÷���ȡ��Z���з���ȡ�����ڼӸߴ�ˮʱ�����[��c��H+��]���ͣ�HCl��Ũ��+FeCl3?HFeCl4ƽ����ת��ΪFeCl3�ķ����ƶ��������øߴ�ˮ���Խ��з���ȡ��ȥ���л��༴�ɵõ��ϴ��ĺ�Fe3+����Һ������ȡʱCa2+��Mn2+��Cu2+Ӧ����ȥ��ˮ���У�����ȡ����ȥ�л���õ�����Һ�м������õ��������������������յõ��ߴ����������ݴ˴��⣮
��� �⣺��1���������̷�����֪�õ��IJ���Ϊ�ܽ⡢��ȡ��Һ��ȼ�գ�û���õ���װ��Ϊ�٢ܣ��ʴ�Ϊ���٢ܣ�
��2���ٸ�������ͼ��֪��FeCl3��Ʒ�������ᣬ�õ�����Fe3+��Ca2+��Mn2+��Cu2+�����ӵ���Һ����X��ȡ���ٷ���ȡȥ���л��༴�ɵõ��ϴ��ĺ�Fe3+����Һ����������ȡʱCa2+��Mn2+��Cu2+Ӧ��ˮ���У�
�ʴ�Ϊ��ˮ��
�ڷ�Һʱ��Ϊ��֤Һ��˳�����£�Ӧ�� ʹ��Һ©�������ѹǿ��ȣ�����Ӧ�Ƚ���Һ©���ϵIJ�������ʹ���ϵİ��۶�©�����ϵ�С�ף��ٴ�������
�ʴ�Ϊ������Һ©���ϵIJ�������ʹ���ϵİ��۶�©�����ϵ�С�ף�
��3������ʱ��Ӧ���¶ȼ�ˮ�������� ������ƿ֧�ܿڴ������춡����ͪ�к���������ͪ��4-��-2-�紼���������ʵ����ʣ��ᴿ���춡����ͪ����������ķ���������ǰ���ֲ�Ʒ����ˮϴ����ȥ���ֿ��ܵ����ʣ�����̼��������Һϴ�ӣ���ȥ�������ʣ�����ˮϴ����ȥ̼�����Ƶ����ʣ�������
�ʴ�Ϊ��������ƿ֧�ܿڴ���A��B��A��
��4����������ķ�����֪�����ڼӸߴ�ˮʱ�����[��c��H+��]���ͣ�HCl��Ũ��+FeCl3?HFeCl4ƽ����ת��ΪFeCl3�ķ����ƶ��������øߴ�ˮ���Խ��з���ȡ��
�ʴ�Ϊ��A���Ӹߴ�ˮʱ�����[��c��H+��]���ͣ�HCl��Ũ��+FeCl3?HFeCl4ƽ����ת��ΪFeCl3�ķ����ƶ���
��5���ٸ���ͼ3��֪���ζ���ʼ�Ķ���Ϊ0.8mL���յ��Һ��Ķ���Ϊ20.8mL����������K2Cr2O7����Һ���Ϊ20mL��
�ʴ�Ϊ��20��
��K2Cr2O7�����ʵ���Ϊ0.1000mol/L��0.02L=0.002mol�����ݵ��ӵ�ʧ�غ��й�ϵʽ6Fe2+��K2Cr2O7��������Ʒ����Ԫ�ص����ʵ���Ϊ0.012mol�����Բ�Ʒ���������ĺ���Ϊ$\frac{0.012��\frac{1}{2}��160}{W}$��100%=$\frac{96}{W}$%��
�ʴ�Ϊ��$\frac{96}{W}$%��
��6�����ݵ��ӵ�ʧ�غ��Ԫ���غ��֪������FeSO4•7H2O���������Ļ�ѧ����ʽΪ2FeSO4•7H2O $\frac{\underline{\;\;��\;\;}}{\;}$ Fe2O3+SO2+SO3+7H2O��
�ʴ�Ϊ��2FeSO4•7H2O $\frac{\underline{\;\;��\;\;}}{\;}$ Fe2O3+SO2+SO3+7H2O��
���� ���⿼�������ʷ����ᴿ�ķ����������漰ʵ��������������ӷ���ʽ����д����ѧ�����֪ʶ��ע�ⷴӦ������ԭ���غ������Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�

| A�� | A�缫�Ϸ����ĵ缫��Ӧ�ǻ�ԭ��Ӧ | |
| B�� | A�Ľ�����ǿ��B | |
| C�� | ���Ӳ�����A�缫�����·����B�缫 | |
| D�� | ��Һ�е����������� |
| A�� | ���£�NaHCO3�ܽ�ȱ�Na2CO3С����Na2CO3��Һ��ͨ��CO2�������� | |
| B�� | ���£�SiO2������ᡢNaOH��Һ���ɷ�Ӧ��SiO2������������ | |
| C�� | BaSO3������ˮ��SO2����ͨ��Ba��NO3��2��Һ�в������� | |
| D�� | �ǽ����ԣ�Cl��S�����ԣ�HClO��H2SO4 |
| A�� | 100mL1mol/LNa2CO3��Һ�к���0.1NA��CO32- | |
| B�� | ��⾫��ͭʱ���������õ�������Ϊ2NA����������������64g | |
| C�� | 1molCl2�����Fe��Ӧ��ת�Ƶĵ�����Ϊ2 NA | |
| D�� | ��״���£�11.2L�Ҵ���ȫȼ�ղ���������̼������ΪNA |
| A�� | �����ڱ��У�Ԫ�ص���������������ԭ�ӵ����������� | |
| B�� | ���ڱ��зǽ�������ǿ��Ԫ�أ�������������ˮ��������Ҳ��ǿ | |
| C�� | ͬ����Ԫ����ԭ�Ӻ˵�����ĵ�����ԭ�Ӱ뾶�������� | |
| D�� | �ڢ�A��Ԫ�صĵ��ʣ���������������ۡ��е����ߣ���A�嵥�ʣ���������������ۡ��е����� |
| ������ | Fe��OH��2 | Fe��OH��3 | Mn��OH��2 | Zn��OH��2 |
| ������ʼʱpH | 7.5 | 2.2 | 8.8 | 6.5 |
| ������ȫʱpH | 9.5 | 3.7 | 10.8 | 8.5 |
��1������I�õ���������Ҫ�ɷ���̼�ڣ�
��2�����������������NaOH��Һ����pH�ķ�ΧΪ8.5��pH��8.8���������dz�ȥ��Һ�е�Fe3+��Zn2+��
��3������II����Һ����������Ҫ��Mn2+��
��4�����̢��У���ҺB��NH4Cl�������ɵ�����A��CO2��
��5����д������п�̸ɵ�������̷��и���������ܷ�ӦʽZn+2MnO2+2NH4Cl=Zn��NH3��2Cl2+2MnOOH��
��6����4.00g�̷���ȫ���������������̢�����MnO2�����Դ˲ⶨ������Ԫ�صĺ�����
��������ȡ��MnO2�м�������ữ��0.50mol/L H2C2O4 50.00mLMnO2��ȫ�ܽ⣬������A���壬д���÷�Ӧ�����ӷ�Ӧ����ʽ��MnO2+H2C2O4+2H+=Mn2++2CO2 ��+2H2O��
Ȼ����0.10mol/LKMnO4��Һ�ζ�������H2C2O4��Һ���������Ϸ�Ӧһ�£����ζ��յ�ʱ����KMnO4��Һ30.00mL�����̷��е���Ԫ������������24.1%������2λ��Ч���֣���
 CO��g��+3H2��g����H=-��a+b-3C��kJ��mol-1��
CO��g��+3H2��g����H=-��a+b-3C��kJ��mol-1��
 �����dzµ��㡱������Ϊ���ڴ������������������ζ��������������ʵ�������ǿ�������ͼ��ʾ��װ����ȡ����������
�����dzµ��㡱������Ϊ���ڴ������������������ζ��������������ʵ�������ǿ�������ͼ��ʾ��װ����ȡ����������