题目内容
6.有a、b、c、d四种金属.将a与b用导线连接起来,浸入电解质溶液中,外电路电流从b流向a.将a、d分别投入到等浓度盐酸中,d比a反应剧烈.将铜浸入b的盐溶液中,无明显变化.如果把铜浸入c的盐溶液中,有金属c析出.据此判断它们的活动性由强到弱的顺序是( )| A. | dcab | B. | dabc | C. | dbca | D. | dbac |
分析 原电池中被腐蚀的金属是活动性强的金属;金属和相同的酸反应时,活动性强的金属反应剧烈;金属的置换反应中,较活泼金属能置换出较不活泼的金属.
解答 解:两种活动性不同的金属和电解质溶液构成原电池,较活泼的金属作负极,负极上金属失电子发生氧化反应被腐蚀,较不活泼的金属作正极,将a与b用导线连接起来浸入电解质溶液中,外电路电流从b流向a,b为正极,a为负极,所以a的活动性大于b;
金属和相同的酸反应时,活动性强的金属反应剧烈,将a、d分别投入等浓度盐酸溶液中,d比a反应剧烈,所以d的活动性大于a;
金属的置换反应中,较活泼金属能置换出较不活泼的金属,将铜浸入b的盐溶液中,无明显变化,说明b的活动性大于铜;
如果把铜浸入c的盐溶液中,有金属c析出,说明铜的活动性大于c.
所以金属的活动性顺序为:d>a>b>c,
故选B.
点评 本题考查了金属活动性强弱的判断,难度不大,能从原电池的负极、金属之间的置换反应、金属与酸或水反应的剧烈程度、金属氧化物的水化物的碱性强弱等方面来判断金属的活动性强弱.

练习册系列答案
相关题目
14.C60是60个碳原子形成的封闭笼状分子,形似足球 ,它与石墨互为( )
,它与石墨互为( )
 ,它与石墨互为( )
,它与石墨互为( )| A. | 同位素 | B. | 同素异形体 | C. | 同种分子 | D. | 同一物质 |
1.关于如图所示的氢氧燃料电池的说法错误的是( )
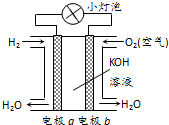

| A. | 电极a是负极 | |
| B. | 电极a上的电极反应为2H2-4e-=4H+ | |
| C. | 外电路中电子由电极a流向电极b | |
| D. | 氢氧燃料电池的优点是高效、对环境友好 |
11.下列物质能由两种单质直接化合得到的是( )
| A. | FeCl2 | B. | CuS | C. | NO2 | D. | SO2 |
18.下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A. | 它们的原子半径、失电子能力随核电荷数的增加而增大 | |
| B. | 被其它卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大 | |
| C. | 它们的氢化物的稳定性随核电荷数的增加而增强 | |
| D. | 单质的颜色随核电荷数的增加而加深 |
15.下列说法正确的是( )
| A. | 直径为20 nm的纳米碳酸钙属于胶体 | |
| B. | 海水中提取镁的各步反应均为氧化还原反应 | |
| C. | 光导纤维是一种新型硅酸盐材料 | |
| D. | 可溶性铁盐和铝盐可用作净水剂 |