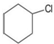
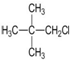
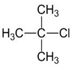
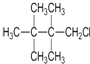
题目内容
3.由A、B两种金属和稀硫酸组成的原电池,A是正极,则下列推断正确的是( )| A. | A电极上发生的电极反应是还原反应 | |
| B. | A的金属性强于B | |
| C. | 电子不断由A电极经外电路流向B电极 | |
| D. | 溶液中的阳离子移向负极 |
分析 原电池中较活泼的金属是负极,失去电子,发生氧化反应,电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此分析.
解答 解:A.A是正极,正极得到电子,发生还原反应,故A正确;
B.两种金属A与B和稀硫酸组成原电池时,A是正极,这说明金属性是B强于A,故B错误;
C.电子不断由B电极经外电路流向A电极,说明A为负极,与已知不符,故C错误;
D.阳离子向正极移动,故D错误;
故选A.
点评 本题考查了原电池原理,根据得失电子判断反应类型及电极,题目难度不大,侧重于基础知识的考查.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | Fe3+具有氧化性,Fe2+具有还原性 | |
| B. | Fe3+的水溶液呈红褐色,Fe2+的水溶液呈浅绿色 | |
| C. | Fe2+的溶液中滴入强碱溶液,立即出现红褐色沉淀 | |
| D. | 铁可以在氧气中燃烧生成Fe2O3 |
18.下列关于化学反应速率的说法正确的是( )
| A. | 因是同一反应,所以用不同物质表示化学反应速率时,所得数值是相同的 | |
| B. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| C. | 化学反应速率为“1 mol/(L•min)”表示的意思是:时间为1 min 时,某物质的浓度为1 mol/L | |
| D. | 化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加 |
12.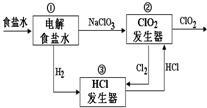 利用食盐水制取ClO2的工业流程如图所示.
利用食盐水制取ClO2的工业流程如图所示.
装置①中的反应:NaCl+3H2O$\stackrel{通直流电}{→}$NaClO3+3H2↑
装置②中的反应:2NaClO3+4HCl→2ClO2+Cl2↑+2NaCl+2H2O
下列关于该流程的说法正确的是( )
 利用食盐水制取ClO2的工业流程如图所示.
利用食盐水制取ClO2的工业流程如图所示.装置①中的反应:NaCl+3H2O$\stackrel{通直流电}{→}$NaClO3+3H2↑
装置②中的反应:2NaClO3+4HCl→2ClO2+Cl2↑+2NaCl+2H2O
下列关于该流程的说法正确的是( )
| A. | 该流程中仅NaCl可循环利用 | |
| B. | 装置①中H2是阴极产物 | |
| C. | 装置②中Cl2是还原产物 | |
| D. | 为使H2完全转化为HCl,还应向装置③中再补充Cl2 |