题目内容
 回答下列问题.
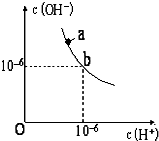
回答下列问题.(1)如图,某温度(t℃)时水的图象如下,a点离子积KW=
(2)25℃时,向0.1mol?L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH
(3)体积相等的稀NaOH和CH3COOH溶液混合,若溶液中c(Na+)=c(CH3COO-),则该溶液显
(4)常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全(残留在溶液中的c(Fe3+)<10-5 mol?L-1),则溶液的pH最小为
(5)用可溶性碳酸盐,可以浸取CaSO4固体,则溶浸过程中会发生反应:CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq).已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为
考点:pH的简单计算,难溶电解质的溶解平衡及沉淀转化的本质,酸碱混合时的定性判断及有关ph的计算
专题:
分析:(1)根据离子积常数=c(H+)×c(OH-)进行计算;根据水的离子积计算酸碱溶液中氢离子、氢氧根离子浓度,根据硫酸中氢离子与氢氧化钠中氢氧根离子的物质的量判断碱过量;
(2)向氨水中加入氯化铵,铵根离子浓度的抑制一水合氨电离;
(3)根据电荷守恒判断,醋酸钠溶液呈碱性,要使醋酸和氢氧化钠的混合溶液呈中性,则醋酸应该稍微过量;
(4)依据氢氧化铁的溶度积常数和Fe3+沉淀完全的浓度为c(Fe3+)<10-5mol?L-1,计算氢氧根离子浓度得到溶液最小pH;
(5)以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq)平衡常数概念写出计算式,依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同计算分析;
(2)向氨水中加入氯化铵,铵根离子浓度的抑制一水合氨电离;
(3)根据电荷守恒判断,醋酸钠溶液呈碱性,要使醋酸和氢氧化钠的混合溶液呈中性,则醋酸应该稍微过量;
(4)依据氢氧化铁的溶度积常数和Fe3+沉淀完全的浓度为c(Fe3+)<10-5mol?L-1,计算氢氧根离子浓度得到溶液最小pH;
(5)以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq)平衡常数概念写出计算式,依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同计算分析;
解答:
解:(1)根据图知,当c(H+)=10-6 mol/L,c(OH-)=10-6 mol/L,由离子积常数=c(H+)×c(OH-)=10-6.×10-6=10-12,pH=2的H2SO4溶液中c(H+)=0.01mol/L,pH=12的NaOH中c(OH-)=
=1mol/L,等体积混合时碱过量,溶液呈碱性,
故答案为:1.0×10-12;碱;
(2)一水合氨为弱电解质,溶液中存在电离平衡NH3?H2O?NH4++OH-,向氨水中加入氯化铵时,溶液中铵根离子浓度增大,抑制一水合氨电离,溶液中氢氧根离子浓度减小,则pH减小,
故答案为:减小;增大;
(3)溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(Na+)=c(CH3COO-),所以c(OH-)=c(H+),所以溶液呈中性;醋酸钠溶液呈碱性,要使醋酸和氢氧化钠的混合溶液呈中性,则醋酸应该稍微过量,因为二者的体积相等,所以醋酸的浓度大于氢氧化钠,
故答案为:中性,<;
(4)常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全,残留在溶液中的c(Fe3+)<10-5mol?L-1;Ksp=c(Fe3+)c3(OH-)=10-5×c3(OH-)=1×10-38 c(OH-)=10-11mol/L,c(H+)=
=10-3mol/L,溶液PH=3;
故答案为:3;
(5)溶浸过程中会发生:CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq),CaCO3(s)=Ca2++CO32-;CaSO4(s)=Ca2++SO42-;依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同计算,反应的平衡常数K=
=
=
=1.75×104,
故答案为:1.75×104;
| 10-12 |
| 10-12 |
故答案为:1.0×10-12;碱;
(2)一水合氨为弱电解质,溶液中存在电离平衡NH3?H2O?NH4++OH-,向氨水中加入氯化铵时,溶液中铵根离子浓度增大,抑制一水合氨电离,溶液中氢氧根离子浓度减小,则pH减小,
故答案为:减小;增大;
(3)溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(Na+)=c(CH3COO-),所以c(OH-)=c(H+),所以溶液呈中性;醋酸钠溶液呈碱性,要使醋酸和氢氧化钠的混合溶液呈中性,则醋酸应该稍微过量,因为二者的体积相等,所以醋酸的浓度大于氢氧化钠,
故答案为:中性,<;
(4)常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全,残留在溶液中的c(Fe3+)<10-5mol?L-1;Ksp=c(Fe3+)c3(OH-)=10-5×c3(OH-)=1×10-38 c(OH-)=10-11mol/L,c(H+)=
| 10-14 |
| 10-11 |
故答案为:3;
(5)溶浸过程中会发生:CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq),CaCO3(s)=Ca2++CO32-;CaSO4(s)=Ca2++SO42-;依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同计算,反应的平衡常数K=
| c(SO42-) |
| c(CO32-) |
| Ksp(CaSO4) |
| Ksp(CaCO3) |
| 4.90×10-5 |
| 2.80×10-9 |
故答案为:1.75×104;
点评:本题考查了酸碱混合溶液定性判断、盐类水解、溶度积常数的计算等知识点,明确物质的性质是解本题关键,再结合盐类水解的影响因素结合电荷守恒来分析解答,题目难度中等,难点是平衡常数的计算应用,溶度积的计算分析.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
对于某些离子的检验及结论一定正确的是( )
| A、取样,加入紫色石蕊,溶液变红,一定有H+ |
| B、取样,加入氯化钡溶液有白色沉淀产生.再加盐酸,沉淀不消失,一定有SO42- |
| C、取样,加入硝酸银有白色沉淀,一定有Cl- |
| D、取样,加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
 四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是大气污染物.下列有关判断正确的是( )
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是大气污染物.下列有关判断正确的是( )| A、简单氢化物的热稳定性:C>A |
| B、最高价氧化物对应水化物的酸性:D<C |
| C、B的最高价氧化物的水化物能与D的最高价氧化物的水化物反应 |
| D、A、C、D的最高价含氧酸的钠盐水溶液可能均显碱性 |