题目内容
X、Y、Z、W是元素周期表前四周期中的常见元素.其相关信息如下表:
(1)Z位于元素周期表的位置 ,写出Z的原子结构示意图 .
(2)Y的电负性比Z的 (填“大“或”小”);X和Y的气态氢化物中,较稳定的是 (写化学式).
(3)X的一种氢化物H2X2分子中极性键和非极性健数目之比为 .
(4)Z的一种单质与烧碱溶液作用可以生产日常生活用的消毒剂,请写出其反应的离子方程式: .
(5)已知28gW在氧气中燃烧,放出186.4kJ的热量,请写出此反应的热化学方程式: .
| 元素 | 相关信息 |
| X | X的一种核素的质量数为18,中子数为10 |
| Y | Y与X同主族,且它的一种氧化物是导致酸雨的主要物质之一 |
| Z | Z的单质常温下为黄绿色气体 |
| W | W的基态原子核外有4个未成对电子 |
(2)Y的电负性比Z的
(3)X的一种氢化物H2X2分子中极性键和非极性健数目之比为
(4)Z的一种单质与烧碱溶液作用可以生产日常生活用的消毒剂,请写出其反应的离子方程式:
(5)已知28gW在氧气中燃烧,放出186.4kJ的热量,请写出此反应的热化学方程式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X的一种核素的质量数为18,中子数为10,质子数=18-10=8,该元素为O;
Y与X同主族,且它的一种氧化物是导致酸雨的主要物质之一,则Y为S;
Z的单质常温下为黄绿色气体,黄绿色气体为氯气,则Z为Cl;
W基态原子核外有4个未成对电子,应处于都是周期,则核外电子排布式为1s22s22p63s23p63d64s2,则W为Fe元素;
(1)Z的单质常温下为黄绿色气体,黄绿色气体为氯气,则Z为Cl,位于周期表的第三周期ⅦA族,核外电子排布为2、8、7;
(2)同一周期从左到右,电负性逐渐增强;非金属性越强,气态氢化物越稳定;
(3)X的一种氢化物H2X2分子是H2O2,O-H为极性键、O-O为非极性键;
(4)氯气和氢氧化钠溶液反应生成次氯酸钠,可以生产日常生活用的消毒液体;
(5)铁在氧气中燃烧生成四氧化三铁,28g铁的物质的量为0.5mol,因此3mol铁完全反应放出的热量为3×2×186.4kJ=1118.4kJ.
Y与X同主族,且它的一种氧化物是导致酸雨的主要物质之一,则Y为S;
Z的单质常温下为黄绿色气体,黄绿色气体为氯气,则Z为Cl;
W基态原子核外有4个未成对电子,应处于都是周期,则核外电子排布式为1s22s22p63s23p63d64s2,则W为Fe元素;
(1)Z的单质常温下为黄绿色气体,黄绿色气体为氯气,则Z为Cl,位于周期表的第三周期ⅦA族,核外电子排布为2、8、7;
(2)同一周期从左到右,电负性逐渐增强;非金属性越强,气态氢化物越稳定;
(3)X的一种氢化物H2X2分子是H2O2,O-H为极性键、O-O为非极性键;
(4)氯气和氢氧化钠溶液反应生成次氯酸钠,可以生产日常生活用的消毒液体;
(5)铁在氧气中燃烧生成四氧化三铁,28g铁的物质的量为0.5mol,因此3mol铁完全反应放出的热量为3×2×186.4kJ=1118.4kJ.
解答:
解:X的一种核素的质量数为18,中子数为10,质子数=18-10=8,该元素为O;
Y与X同主族,且它的一种氧化物是导致酸雨的主要物质之一,则Y为S;
Z的单质常温下为黄绿色气体,黄绿色气体为氯气,则Z为Cl;
W基态原子核外有4个未成对电子,应处于都是周期,则核外电子排布式为1s22s22p63s23p63d64s2,则W为Fe元素;
(1)Z的单质常温下为黄绿色气体,黄绿色气体为氯气,则Z为Cl,位于周期表的第三周期ⅦA族,Cl的原子结构示意图为 ,
,
故答案为:第三周期ⅦA族; ;
;
(2)同一周期从左到右,电负性逐渐增强,因此S的电负性小于Cl,非金属性O>S,气态氢化物越稳定,因此稳定性:H2O>H2S,
故答案为:小;H2O;
(3)X的一种氢化物H2X2分子是H2O2,O-H为极性键、O-O为非极性键,因此极性键和非极性健数目之比为2:1,故答案为:2:1;
(4)氯气和氢氧化钠溶液反应生成次氯酸钠,可以生产日常生活用的消毒液体,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)铁在氧气中燃烧生成四氧化三铁,28g铁的物质的量为0.5mol,因此3mol铁完全反应放出的热量为3×2×186.4kJ=1118.4kJ,热化学方程式为3Fe(s)+2O2(g)=Fe2O3(s)△H=-1118.4kJ?mol-1,
故答案为:3Fe(s)+2O2(g)=Fe2O3(s)△H=-1118.4kJ?mol-1.
Y与X同主族,且它的一种氧化物是导致酸雨的主要物质之一,则Y为S;
Z的单质常温下为黄绿色气体,黄绿色气体为氯气,则Z为Cl;
W基态原子核外有4个未成对电子,应处于都是周期,则核外电子排布式为1s22s22p63s23p63d64s2,则W为Fe元素;
(1)Z的单质常温下为黄绿色气体,黄绿色气体为氯气,则Z为Cl,位于周期表的第三周期ⅦA族,Cl的原子结构示意图为
 ,
,故答案为:第三周期ⅦA族;
 ;
;(2)同一周期从左到右,电负性逐渐增强,因此S的电负性小于Cl,非金属性O>S,气态氢化物越稳定,因此稳定性:H2O>H2S,
故答案为:小;H2O;
(3)X的一种氢化物H2X2分子是H2O2,O-H为极性键、O-O为非极性键,因此极性键和非极性健数目之比为2:1,故答案为:2:1;
(4)氯气和氢氧化钠溶液反应生成次氯酸钠,可以生产日常生活用的消毒液体,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)铁在氧气中燃烧生成四氧化三铁,28g铁的物质的量为0.5mol,因此3mol铁完全反应放出的热量为3×2×186.4kJ=1118.4kJ,热化学方程式为3Fe(s)+2O2(g)=Fe2O3(s)△H=-1118.4kJ?mol-1,
故答案为:3Fe(s)+2O2(g)=Fe2O3(s)△H=-1118.4kJ?mol-1.
点评:本题考查结构性质位置关系应用,涉及核外电子排布规律、化学键、常用化学用语书写、元素化合物性质与推断等,难度中等,推断元素是解题关键,注意对核外电子排布规律的理解掌握.

练习册系列答案
相关题目


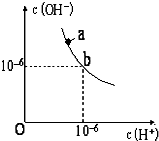 回答下列问题.
回答下列问题.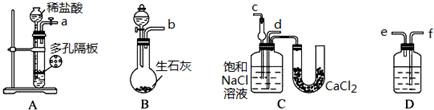
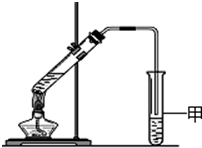 通过粮食发酵可获得某含氧有机物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%.
通过粮食发酵可获得某含氧有机物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%.
