题目内容
4.在室温下,100ml 0.1mol/L的醋酸溶液中,欲使其溶液的pH值减小,但又要使醋酸电离程度减少,应采取( )| A. | 加入少量CH3COONa固体 | B. | 通入少量氯化氢气体 | ||
| C. | 提高温度 | D. | 加入大量水 |
分析 醋酸是弱电解质,要使溶液溶液的pH减小,可以采取升高温度、加入酸的方法;如果使其电离程度减小,则平衡向正反应方向移动,可以向溶液中加入含有氢离子或醋酸根离子的物质,二者结合分析解答.
解答 解:A.向溶液中加入醋酸钠固体,醋酸根离子浓度增大,抑制醋酸电离,但溶液pH增大,故A错误;
B.向溶液中通入氯化氢气体,氯化氢电离出氢离子导致溶液中氢离子浓度增大,溶液的pH减小,同时抑制醋酸电离,故B正确;
C.醋酸的电离过程为吸热过程,升高温度促进醋酸电离,故C错误;
D.加入水促进醋酸电离,溶液中氢离子浓度减小,故D错误;
故选B.
点评 本题考查了弱电解质电离影响因素,明确哪些条件促进醋酸电离哪些条件抑制醋酸电离是解本题关键,题目难度不大,侧重于考查学生的分析能力.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
16.氨水是实验室中的常用试剂.某课外活动小组欲通过实验测定NH3•H2O的电离常数.
【讨论】选用以下试剂和仪器:浓度大约为0.1mol/L的氨水、0.1000mol/L盐酸、甲基橙、蒸馏水、酸式滴定管、碱式滴定管、锥形瓶、胶头滴管、烧杯、pH计、铁架台
在组装仪器是发现缺少了一种仪器,缺少的仪器是滴定管夹.添加这种仪器后进行实验.
【实验过程】
【反思】:该小组在实验条件下测得氨水的电离常数K=1.60×10-5.查阅资料得知:25℃时氨水的电离常数K=1.75×10-5.检查滴定过程操作、计算均没有错误,该小组讨论后认为实验测得氨水的电离常数是准确的,但是应该补充一项实验内容,补充的实验内容是测定氨水的温度.
【拓展应用】25℃时,pH=5的氯化铵溶液中$\frac{c({H}^{+})×c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=0.175.(写出推导过程并计算出结果)
【讨论】选用以下试剂和仪器:浓度大约为0.1mol/L的氨水、0.1000mol/L盐酸、甲基橙、蒸馏水、酸式滴定管、碱式滴定管、锥形瓶、胶头滴管、烧杯、pH计、铁架台
在组装仪器是发现缺少了一种仪器,缺少的仪器是滴定管夹.添加这种仪器后进行实验.
【实验过程】
| 实验步骤 | 实验目的 |
| (滴定前的所有操作正确,已略去) 步骤1: ①用碱式滴定管量取20.00mL的氨水放入锥形瓶中,滴入2滴甲基橙. ②用酸式滴定管取0.1000mol/L盐酸滴定氨水. ③当锥形瓶中的溶液由黄色变成橙色时,停止滴定,纪录数据. ④重复滴定操作2~3次. | 测定氨水的准确浓度 |
| 步骤2:用pH计测定氨水的pH. | 测定氨水中c(OH-)浓度 |
| 步骤3:通过实验数据计算氨水的电离常数K | |
【拓展应用】25℃时,pH=5的氯化铵溶液中$\frac{c({H}^{+})×c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=0.175.(写出推导过程并计算出结果)
14.下列物质属于电解质且能导电的是( )
| A. | 铁 | B. | 熔融的氢氧化钠 | C. | 食盐水 | D. | 硫酸 |
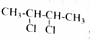 为原料制备某五元环化合物的流程如图所示:
为原料制备某五元环化合物的流程如图所示: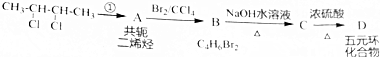
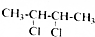 的系统命名为2,3-二氯丁烷.
的系统命名为2,3-二氯丁烷.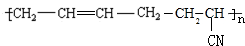 等.
等. .
. 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: .
.