题目内容
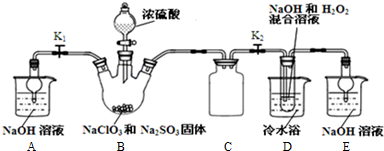
14.下列物质属于电解质且能导电的是( )| A. | 铁 | B. | 熔融的氢氧化钠 | C. | 食盐水 | D. | 硫酸 |
分析 在水溶液或熔化状态下能导电的化合物为电解质,有自由移动电子或离子的物质能导电,以此来解答.
解答 解:A.铁中有自由电子,能导电,但属于单质,则既不是电解质也不是非电解质,故A错误;
B.熔融的氢氧化钠有自由移动的离子,能导电,属于化合物,则属于电解质,故B正确;
C.食盐水是氯化钠溶液能导电,但不是电解质属于电解质溶液,故C错误;
D.硫酸中无自由移动的离子,不能导电,属于纯净物,溶于水导电是电解质,故D错误;
故选B.
点评 本题考查电解质和非电解质,明确概念的要点即可解答,抓住化合物来分析是解答的关键,并注意导电的原因来解答,题目难度不大.

练习册系列答案
相关题目
4.在室温下,100ml 0.1mol/L的醋酸溶液中,欲使其溶液的pH值减小,但又要使醋酸电离程度减少,应采取( )
| A. | 加入少量CH3COONa固体 | B. | 通入少量氯化氢气体 | ||
| C. | 提高温度 | D. | 加入大量水 |
19.下列说法正确的是( )
| A. | Na2O2是碱性氧化物 | |
| B. | Na2O2中阴阳离子个数比为1:1 | |
| C. | 可用澄清石灰水来区分Na2CO3 和NaHCO3 | |
| D. | 与同浓度盐酸反应的剧烈程度:NaHCO3>Na2CO3 |
6.下列有关电解质溶液中粒子的物质的量浓度大小关系正确的是( )
| A. | 等物质的量浓度的下列溶液:①H2CO3、②Na2CO3、③NaHCO3、④(NH4)2CO3:其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2 的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
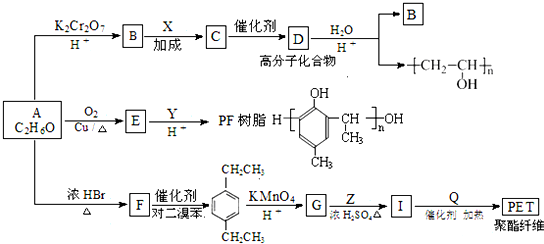
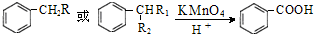 (R为H原子或烃基)
(R为H原子或烃基)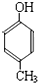
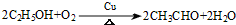
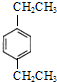 的同分异构体W也能被酸性高锰酸钾溶液氧化为G,W的所有可能结构简式为
的同分异构体W也能被酸性高锰酸钾溶液氧化为G,W的所有可能结构简式为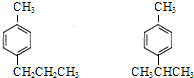

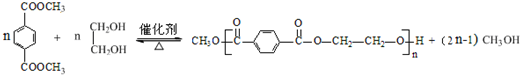 .
.
 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.