题目内容
6.用NA表示阿伏德罗常数,下列叙述正确的是( )| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,1molNa2CO3含有的Na+离子数为2 NA | |
| C. | 通常状况下,1 NA 个CO2分子占有的体积为22.4L | |
| D. | 1mol/L的MgCl2溶液中,含有Cl- 个数为2 NA |
分析 A.标准状况下水的状态不是气体,不能使用标准状况下的气体摩尔体积计算;
B.1molNa2CO3中含有2mol钠离子;
C.不是标准状况下,不能使用标准状况下的气体摩尔体积计算;
D.缺少氯化镁溶液的体积,无法计算氯离子的数目.
解答 解:A.标准状况下,是不是气体,不能使用标准状况下的气体摩尔体积计算22.4L水的体积,故A错误;
B.1molNa2CO3含有2mol钠离子,含有的Na+离子数为2NA,故B正确;
C.通常状况下,不能使用标准状况下的气体摩尔体积计算二氧化碳的体积,故C错误;
D.没有告诉1mol/L的MgCl2溶液的体积,无法计算溶液中含有的氯离子的数目,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标准状况下气体摩尔体积的使用条件,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系.

练习册系列答案
相关题目
17.某化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示.下列有关评价正确的是( )
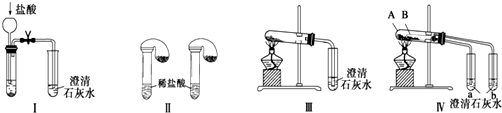

| A. | 根据图Ⅰ所示实验,可以根据澄清石灰水是否变浑浊鉴别碳酸钠和碳酸氢钠固体 | |
| B. | 在图Ⅱ所示实验的左右两只试管中加入足量的盐酸,然后向两个气球中分别加入等物质的量的碳酸钠和碳酸氢钠固体,根据反应后气球的大小可鉴别两种固体 | |
| C. | 与实验Ⅲ相比,实验Ⅳ的突出优点是可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 | |
| D. | 若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则小试管B中装入的固体是碳酸钠 |
1.4mol•L-1的KOH溶液100mL,取出5mL,这5mL溶液中K+浓度为( )
| A. | 4 mol•L-1 | B. | 0.2mol•L-1 | C. | 2 mol•L-1 | D. | 0.4 mol•L-1 |
18.下列有关钠、铁、铝性质的说法中不正确的是( )
| A. | 在地壳中的含量:Al>Fe>Na | |
| B. | 均能与盐酸反应,但金属钠与盐酸的反应最剧烈 | |
| C. | 钠、铝均能从FeCl3溶液中置换出铁单质 | |
| D. | 钠、铝均能与NaOH溶液反应,但参加反应的物质种类前者少于后者 |
16.下列说法正确的是( )
| A. | C2H6与C3H8没有同分异构体,CH2O2与C2H4O2属于同系物 | |
| B. | 一定条件下,乙酸乙酯、淀粉、蛋白质、乙烯都能与水发生水解反应 | |
| C. | 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,则生成水的质量为18(1-a)g | |
| D. | 全降解塑料(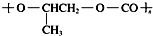 )可由单体环氧丙烷( )可由单体环氧丙烷(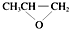 )和CO2缩聚制得 )和CO2缩聚制得 |
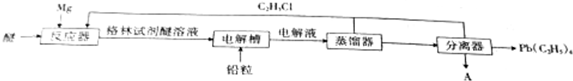
 ,电解物质A的化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
,电解物质A的化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
 ;
;