题目内容
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.
(1)地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ、H2O(l)=2H+(aq)+1/2O2(g)+2e-△H=+284kJ/mol
Ⅱ、CO2(g)+C5(s)+2H+(aq)=2C3+(s)△H=+396kJ/mol
Ⅲ、12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式 .
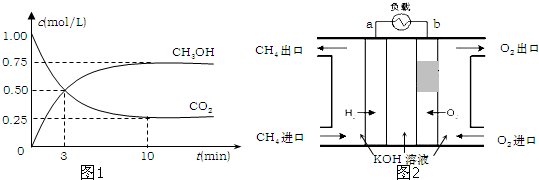
(2)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L?min);
②氢气的转化率= ;
③该反应的平衡常数为 (保留小数点后2位);
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 .
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1mol CO2和3mol H2
⑤当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2.则c1 c2的关系(填>、<、=).
(3)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标.如图2所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.将其插入KOH溶液从而达到吸收CO2的目的.请回答:
①通入甲烷一极的电极反应式为 ;
②随着电池不断放电,电解质溶液的pH (填“增大”、“减小”或“不变”).
③通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.
(1)地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ、H2O(l)=2H+(aq)+1/2O2(g)+2e-△H=+284kJ/mol
Ⅱ、CO2(g)+C5(s)+2H+(aq)=2C3+(s)△H=+396kJ/mol
Ⅲ、12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
(2)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=
②氢气的转化率=
③该反应的平衡常数为
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1mol CO2和3mol H2
⑤当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2.则c1
(3)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标.如图2所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.将其插入KOH溶液从而达到吸收CO2的目的.请回答:
①通入甲烷一极的电极反应式为
②随着电池不断放电,电解质溶液的pH
③通常情况下,甲烷燃料电池的能量利用率

考点:化学平衡的影响因素,用盖斯定律进行有关反应热的计算,原电池和电解池的工作原理
专题:
分析:(1)依据盖斯定律和热化学方程式计算得到所需的热化学方程式,利用热化学方程式的加减消去不需要的物质,注意加减时焓变随之变化;
(2)①根据v=
计算;
②根据氢气的平衡浓度判断转化的物质的量,进而可计算转化率;
③根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算;
④要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动;
⑤恒容密闭容器、反应后整个体系的压强比之前来说减小了,加入氢气虽然正向移动,但是CO2(g)浓度较小、CH3OH(g) 浓度增大、H2O(g)浓度增大,且平衡常数不变;
(3)①甲烷燃料电池中,负极上投放燃料甲烷,发生失电子发生氧化反应,正极上投放氧气,发生得电子的还原反应,总反应是燃料和氧气反应的化学方程式;
②根据电池的总反应确定酸碱性的变化;
③根据能量转化情况来回答.
(2)①根据v=
| △c |
| △t |
②根据氢气的平衡浓度判断转化的物质的量,进而可计算转化率;
③根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算;
④要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动;
⑤恒容密闭容器、反应后整个体系的压强比之前来说减小了,加入氢气虽然正向移动,但是CO2(g)浓度较小、CH3OH(g) 浓度增大、H2O(g)浓度增大,且平衡常数不变;
(3)①甲烷燃料电池中,负极上投放燃料甲烷,发生失电子发生氧化反应,正极上投放氧气,发生得电子的还原反应,总反应是燃料和氧气反应的化学方程式;
②根据电池的总反应确定酸碱性的变化;
③根据能量转化情况来回答.
解答:
解:(1)依据盖斯定律由题干所给的热化学方程式,结合盖斯定律计算(①+②)×6+③得到绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式,
6CO2(g)+6H2O(g)=C6H12O6(葡萄糖、s)+6O2(g)△H=[(+284KJ/mol)+(+396KJ/mol)]×6+(-1200KJ/mol)=+2880KJ/mol;
则△H=[(+284KJ/mol)+(+396KJ/mol)]×6+(-1200KJ/mol)=+2880KJ/mol,即6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g)△H=+2880 kJ?mol-1,
故答案为:6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g)△H=+2880 kJ?mol-1;
(2)①利用三段式解题法计算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=
=0.225 mol?L-1?min-1,
故答案为:0.225;
②氢气的转化率=
×100%=75%,
故答案为:75%;
③平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则K=
=
=5.33,
故答案为:5.33;
④要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则比值减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,比值不变,故D错误.故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方法移动,比值增大,故C正确;
D.再充入1mol CO2和3mol H2,增大反应物浓度,平衡向正反应方向移动,则比值增大,故D正确.
故答案为:CD;
⑤若是恒容密闭容器、反应后整个体系的压强比之前来说减小了,加入氢气虽然正向移动,平衡移动的结果是减弱这种改变,而不能消除这种改变,即虽然平衡正向移动,氢气的物质的量在增加后的基础上减小,但是CO2(g)浓度较小、CH3OH(g) 浓度增大、H2O(g)浓度增大,且平衡常数不变达到平衡时H2的物质的量浓度与加氢气之前相比一定增大,故c1<c2,故答案为:<;
(3)①在碱性溶液中,负极上投放燃料甲烷,发生失电子发生氧化反应:CH4-8e-+10OH-═CO32-+7H2O,故答案为:CH4-8e-+10OH-═CO32-+7H2O;
②燃料电池的总反应是:CH4+2O2+2KOH═K2CO3+3H2O,消耗氢氧根离子,所以碱性减弱,pH减小,故答案为:减小;
③甲烷燃烧时要放出热量、光能,所以燃料电池中甲烷的利用率比甲烷燃烧的能量利用率高,故答案为:大于.
6CO2(g)+6H2O(g)=C6H12O6(葡萄糖、s)+6O2(g)△H=[(+284KJ/mol)+(+396KJ/mol)]×6+(-1200KJ/mol)=+2880KJ/mol;
则△H=[(+284KJ/mol)+(+396KJ/mol)]×6+(-1200KJ/mol)=+2880KJ/mol,即6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g)△H=+2880 kJ?mol-1,
故答案为:6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g)△H=+2880 kJ?mol-1;
(2)①利用三段式解题法计算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=
| 2.25mol/L |
| 10min |
故答案为:0.225;
②氢气的转化率=
| 2.25 |
| 3 |
故答案为:75%;
③平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则K=
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| 0.75×0.75 |
| 0.25×0.753 |
故答案为:5.33;
④要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则比值减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,比值不变,故D错误.故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方法移动,比值增大,故C正确;
D.再充入1mol CO2和3mol H2,增大反应物浓度,平衡向正反应方向移动,则比值增大,故D正确.
故答案为:CD;
⑤若是恒容密闭容器、反应后整个体系的压强比之前来说减小了,加入氢气虽然正向移动,平衡移动的结果是减弱这种改变,而不能消除这种改变,即虽然平衡正向移动,氢气的物质的量在增加后的基础上减小,但是CO2(g)浓度较小、CH3OH(g) 浓度增大、H2O(g)浓度增大,且平衡常数不变达到平衡时H2的物质的量浓度与加氢气之前相比一定增大,故c1<c2,故答案为:<;
(3)①在碱性溶液中,负极上投放燃料甲烷,发生失电子发生氧化反应:CH4-8e-+10OH-═CO32-+7H2O,故答案为:CH4-8e-+10OH-═CO32-+7H2O;
②燃料电池的总反应是:CH4+2O2+2KOH═K2CO3+3H2O,消耗氢氧根离子,所以碱性减弱,pH减小,故答案为:减小;
③甲烷燃烧时要放出热量、光能,所以燃料电池中甲烷的利用率比甲烷燃烧的能量利用率高,故答案为:大于.
点评:本题考查较为综合,涉及热化学、电化学以及化学平衡计算以及平衡移动等问题,题目难度较大,注意根据图象计算各物质的平衡浓度为解答该题的关键.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案
相关题目
下列叙述正确的是( )
| A、熵变小于零而焓变大于零的反应肯定不能发生 |
| B、热化学方程式中△H的值与反应物的用量有关 |
| C、化学反应中旧键断裂吸收能量,新键形成释放能量,所以化学反应伴随能量变化,但反应前后物质的总能量不变 |
| D、用蒸馏水稀释0.1mol/L的醋酸至0.01mol/L,稀释过程中温度维持25℃不变,溶液中各离子浓度均减小 |
鉴别某溶液中是含有Br-还是I-,可以选用的试剂是( )
| A、稀盐酸 | B、四氯化碳 |
| C、淀粉溶液 | D、四氯化碳和氯水 |
室温下,下列各组离子或分子在指定分散系中能大量共存的是( )
| A、FeCl3溶液中:H+、Na+、Cl-、H2O2 | ||||
| B、酸性KMnO4的溶液中:Na+、NO3-、K+、CH3CH2OH | ||||
| C、混有氯化氢气体的氯气中:O2、CH4、N2、NH3 | ||||
D、c(H+)=0.10mol/L的溶液中:NH
|
元素周期律和元素周期表是学习化学的重要工具,下列说法正确的是( )
| A、门捷列夫根据原子量排列的周期表成功预言了类铝(镓)、类硅(锗)等元素的存在 |
| B、铀(U)属于过渡元素,能跟氟形成UF6,据此可推测U原子最外层有6个电子 |
| C、HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱,沸点依次升高 |
| D、Na、Mg、Al原子的最外层电子数依次增加,故失去电子的能力越来越强 |
下列说法正确的是( )
| A、需要加热方能发生的反应一定是吸热反应 |
| B、放热的反应在常温下一定很容易发生 |
| C、反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对大小 |
| D、伴有能量变化的物质变化都是化学变化 |
化学与资源、环境、生活关系密切,下列说法错误的是( )
| A、维生素C具有还原性,在人体内起抗氧化作用 |
| B、新型氢动力计程车可以降低PM2.5的排放,减少大气污染 |
| C、碘是人体必需微量元素,所以要多吃富含高碘酸的食物 |
| D、高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱溶液会“断路” |
下列反应中必须加入还原剂才能进行的是( )
| A、FeCl3→FeCl2 |
| B、Zn→Zn2+ |
| C、H2→H2O |
| D、CuO→CuCl2 |
 某学生在实验室测定一未知浓度的稀盐酸,已知在25mL氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:
某学生在实验室测定一未知浓度的稀盐酸,已知在25mL氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示: