题目内容
元素周期律和元素周期表是学习化学的重要工具,下列说法正确的是( )
| A、门捷列夫根据原子量排列的周期表成功预言了类铝(镓)、类硅(锗)等元素的存在 |
| B、铀(U)属于过渡元素,能跟氟形成UF6,据此可推测U原子最外层有6个电子 |
| C、HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱,沸点依次升高 |
| D、Na、Mg、Al原子的最外层电子数依次增加,故失去电子的能力越来越强 |
考点:元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:A.1869年门捷列夫根据原子量排列的周期表,为第一张元素周期表,利用同主族性质的递变性预言了元素的存在;
B.过渡元素最外层电子数一般不超过2,最高化合价不等于最外层电子数;
C.同主族自上而下非金属性减弱,氢化物还原性增强、氢化物稳定性减弱;HF含氢键沸点最高;
D.同周期,从左向右金属性减弱,与最外层电子数无关.
B.过渡元素最外层电子数一般不超过2,最高化合价不等于最外层电子数;
C.同主族自上而下非金属性减弱,氢化物还原性增强、氢化物稳定性减弱;HF含氢键沸点最高;
D.同周期,从左向右金属性减弱,与最外层电子数无关.
解答:
解:A.1869年门捷列夫根据原子量排列的周期表,为第一张元素周期表,并利用同主族性质的递变性成功预言了类铝(镓)、类硅(锗)等元素的存在,故A正确;
B.过渡元素最外层电子数一般不超过2,最高化合价不等于最外层电子数,不能推测U原子最外层有6个电子,故B错误;
C.F、Cl、Br、I同主族,自上而下非金属性减弱,氢化物还原性增强、氢化物稳定性减弱;HF含氢键沸点最高,沸点为HF>HI>HBr>HCl,故C错误;
D.同周期,从左向右金属性减弱,与最外层电子数无关,则Na、Mg、Al原子的最外层电子数依次增加,且失去电子的能力越来越弱,故D错误;
故选A.
B.过渡元素最外层电子数一般不超过2,最高化合价不等于最外层电子数,不能推测U原子最外层有6个电子,故B错误;
C.F、Cl、Br、I同主族,自上而下非金属性减弱,氢化物还原性增强、氢化物稳定性减弱;HF含氢键沸点最高,沸点为HF>HI>HBr>HCl,故C错误;
D.同周期,从左向右金属性减弱,与最外层电子数无关,则Na、Mg、Al原子的最外层电子数依次增加,且失去电子的能力越来越弱,故D错误;
故选A.
点评:本题考查元素周期表的结构及用应用,为高频考点,把握元素周期律、原子结构与性质等为解答的关键,注意过渡元素与主族元素的结构与性质,题目难度不大.

练习册系列答案
相关题目
下列离子检验的方法正确的是( )
| A、某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- |
| B、某溶液中先滴加足量盐酸无现象,再滴加BaCl2溶液有白色沉淀,则原溶液中有SO42- |
| C、某无色溶液滴入酚酞试液显红色,该溶液一定是含有大量的H+ |
| D、某溶液中滴加稀硫酸生成无色气体,说明原溶液中有CO32- |
下列离子在给定的条件下一定能大量共存的是( )
| A、pH=1的溶液中:Na+、K+、MnO4-、CO32- |
| B、0.1 mol/L NH4HCO3溶液中:K+、Na+、NO3-、Cl- |
| C、c(Fe3+)=0.1 mol/L的溶液中:NH4+、Cl-、AlO2-、SO42- |
| D、室温下,水电离出的c(H+)=1×10-13mo1/L的溶液中:Mg2+、K+、NO3-、Cl- |
下列有关实验操作或判断正确的是( )
| A、配制一定物质的量浓度的溶液,定容时俯视刻度线会导致所配溶液浓度偏小 |
| B、需要95 mL 0.1 mol?L-1NaCl溶液,可选用100 mL容量瓶来配制 |
| C、用100 mL的量筒量取5.2 mL的盐酸 |
| D、用托盘天平称取25.20 g NaCl |
某共价化合物含C、H、N 3种元素,已知其分子内的4个氮原子排列成内空的四面体结构,且每2个氮原子之间都有1个碳原子,分子中无C-C、C═C、C≡C键,则此化合物的化学式是( )
| A、C6H12N4 |
| B、C4H8N4 |
| C、C6H10N4 |
| D、C6H8N4 |
已知:(1)Zn(s)+
O2(g)=ZnO(s)△△H=-348.3kJ/mol
(2)2Ag(s)+
O2(g)=Ag2O(s)△H=-31.0kJ/mol
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△△H等于( )
| 1 |
| 2 |
(2)2Ag(s)+
| 1 |
| 2 |
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△△H等于( )
| A、-317.3 kJ/mol |
| B、-379.3 kJ/mol |
| C、-332.8 kJ/mol |
| D、+317.3 kJ/mol |
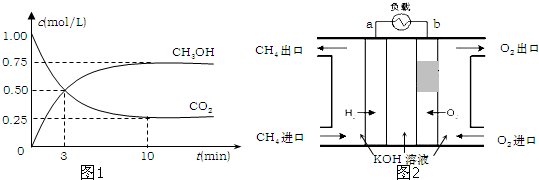
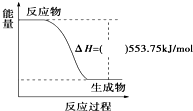 2010年广州亚运会主火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
2010年广州亚运会主火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题: