题目内容
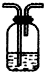
某化学课外活动小组设计如图实验(A装置未画出)探究氮的一些化合物的性质.其中A是某气体发生装置,A中所用试剂从下列固体物质中选择:①NH4HCO3、②NH4Cl、③Ca(OH)2、④NaOH.

检查装置气密性后,先将C装置铂丝网加热至红热,再将A装置产生的气体通过B装置一定时间后,撤去C处酒精灯,铂丝继续保持红热,F中铜片逐渐溶解.
(1)若A中只用一种试剂,该试剂是 (填所选试剂的化学式);A装置中主要的玻璃仪器有 (填名称).
(2)C中发生催化氧化反应的化学方程式为 .
(3)F中Cu片发生反应的离子方程式为 ;假设A、B中药品充足,则F中可以观察到的现象有 .
(4)待实验结束后,将B中固体混合物溶于1mol/L的 500mL盐酸中,产生无色混合气体,且溶液呈中性,则实验前B中原有过氧化钠的物质的量是 mol.
(5)指导老师从安全与环保角度考虑,指出该装置有明显的缺陷,请你提出修改建议: .

检查装置气密性后,先将C装置铂丝网加热至红热,再将A装置产生的气体通过B装置一定时间后,撤去C处酒精灯,铂丝继续保持红热,F中铜片逐渐溶解.
(1)若A中只用一种试剂,该试剂是
(2)C中发生催化氧化反应的化学方程式为
(3)F中Cu片发生反应的离子方程式为
(4)待实验结束后,将B中固体混合物溶于1mol/L的 500mL盐酸中,产生无色混合气体,且溶液呈中性,则实验前B中原有过氧化钠的物质的量是
(5)指导老师从安全与环保角度考虑,指出该装置有明显的缺陷,请你提出修改建议:
考点:性质实验方案的设计
专题:实验设计题
分析:(1)碳酸氢铵受热分解产生氨气、水和二氧化碳,固体加热分解可以在大试管中进行;
(2)C中发生氨气和氧气在催化剂条件下能反应生成一氧化氮和水;
(3)一氧化碳难溶于水,极易和氧气化合为二氧化氮,二氧化氮和水反应生成硝酸,硝酸能将金属铜溶解.
(4)先判断溶液中的溶质,根据钠原子守恒计算过氧化钠的物质的量;盐酸与碳酸钠反应生成的二氧化碳与碳酸氢铵分解生成的二氧化碳相同,根据反应方程式判断二氧化碳和水及过氧化钠之间的关系式,从而计算二氧化碳的体积;
(5)二氧化氮和水反应,为防止倒吸可以在装置E、F之间增加一个防倒吸装置,铜和硝酸反应的产物一氧化氮以及生成的二氧化氮均有毒,应加一个尾气吸收装置.
(2)C中发生氨气和氧气在催化剂条件下能反应生成一氧化氮和水;
(3)一氧化碳难溶于水,极易和氧气化合为二氧化氮,二氧化氮和水反应生成硝酸,硝酸能将金属铜溶解.
(4)先判断溶液中的溶质,根据钠原子守恒计算过氧化钠的物质的量;盐酸与碳酸钠反应生成的二氧化碳与碳酸氢铵分解生成的二氧化碳相同,根据反应方程式判断二氧化碳和水及过氧化钠之间的关系式,从而计算二氧化碳的体积;
(5)二氧化氮和水反应,为防止倒吸可以在装置E、F之间增加一个防倒吸装置,铜和硝酸反应的产物一氧化氮以及生成的二氧化氮均有毒,应加一个尾气吸收装置.
解答:
解:(1)根据题意:C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯,铂丝继续保持红热,F处铜片逐渐溶解,说明有硝酸生成,所以A中获得的是氨气,加热NH4HCO3分解可以产生氨气,固体加热分解可以在大试管中进行,故答案为:①;试管、酒精灯;
(2)C中发生氨气和氧气在催化剂条件下能反应生成一氧化氮和水,4NH3 十 5O2
4NO+6H2O,故答案为:4NH3 十 5O2
4NO+6H2O;
(3)A、B中的药品充足,碳酸氢铵分解产物通过B后生成了氧气,在铂的作用下和氨气反应生成一氧化氮,迅速被氧化为二氧化氮,再和水反应生成硝酸,硝酸和金属铜反应生成硝酸铜、一氧化氮和水,离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,无色的一氧化氮会迅速被氧化为红棕色的二氧化氮,故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;水中产生气泡,溶液逐渐变为蓝色,气体在广口瓶上方变为红棕色;
(4)水和过氧化钠反应生成氢氧化钠和氧气,二氧化碳和过氧化钠反应生成碳酸钠和氧气,将B中固体混合物溶于500mL1mol?L-1 盐酸中,产生无色混合气体,溶液呈中性,所以溶液中的溶质是氯化钠,根据钠原子守恒计算过氧化钠的物质的量,
HCl~NaCl~
Na2O2
1
1mol?L-1×0.5L 0.25mol
所以过氧化钠的物质的量为0.25mol.
故答案为:0.25;
(5)二氧化氮和水反应,为防止倒吸可以在装置E、F之间增加一个防倒吸装置,铜和硝酸反应的产物一氧化氮以及生成的二氧化氮均有毒,应加一个尾气吸收装置,
故答案为:在装置E、F之间增加一个防倒吸装置,在装置F后面增加一个尾气吸收装置.
(2)C中发生氨气和氧气在催化剂条件下能反应生成一氧化氮和水,4NH3 十 5O2
| Pt |
| △ |
| Pt |
| △ |
(3)A、B中的药品充足,碳酸氢铵分解产物通过B后生成了氧气,在铂的作用下和氨气反应生成一氧化氮,迅速被氧化为二氧化氮,再和水反应生成硝酸,硝酸和金属铜反应生成硝酸铜、一氧化氮和水,离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,无色的一氧化氮会迅速被氧化为红棕色的二氧化氮,故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;水中产生气泡,溶液逐渐变为蓝色,气体在广口瓶上方变为红棕色;
(4)水和过氧化钠反应生成氢氧化钠和氧气,二氧化碳和过氧化钠反应生成碳酸钠和氧气,将B中固体混合物溶于500mL1mol?L-1 盐酸中,产生无色混合气体,溶液呈中性,所以溶液中的溶质是氯化钠,根据钠原子守恒计算过氧化钠的物质的量,
HCl~NaCl~
| 1 |
| 2 |
1
| 1 |
| 2 |
1mol?L-1×0.5L 0.25mol
所以过氧化钠的物质的量为0.25mol.
故答案为:0.25;
(5)二氧化氮和水反应,为防止倒吸可以在装置E、F之间增加一个防倒吸装置,铜和硝酸反应的产物一氧化氮以及生成的二氧化氮均有毒,应加一个尾气吸收装置,
故答案为:在装置E、F之间增加一个防倒吸装置,在装置F后面增加一个尾气吸收装置.
点评:本题考查了氨气的制取和性质,难度较大,易错题是(4),会分析整个装置反应过程是解本题的关键.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
常温下,某弱酸的酸式盐NaHA溶液中,c(OH-)<c(A2-),下列有关溶液的说法中正确的是( )
| A、溶液的PH>7 |
| B、溶液中c(Na+)=2c(A2-)+c(HA)+c(H2A) |
| C、加水稀释,c(A2-)/c(HA-)减小 |
| D、加入NaOH固体,可使离子浓度满足:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) |


 和乙酸酐为原料制备
和乙酸酐为原料制备 的合成路
的合成路
 )
)
 油价的持续“高烧”,引发人们对未来能源供需及价格的深切关注,并且促使人们寻求石油的替代品.
油价的持续“高烧”,引发人们对未来能源供需及价格的深切关注,并且促使人们寻求石油的替代品.