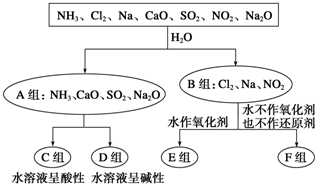
题目内容
12. 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
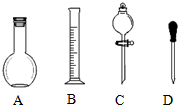
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.(1)在如图所示仪器中,配制上述溶液肯定不需要的是A、C(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是烧杯、玻璃棒、500mL容量瓶.
(2)在容量瓶的使用方法中,下列操作不正确的是B、C、D
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
E.盖好瓶塞,用食指顶住瓶塞,另一只手的手指托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)根据计算用托盘天平称取NaOH固体的质量为2.0g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度小于0.1mol/L(填“大于”“小于”或“等于”).
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为13.6mL,如果实验室有15mL、20mL、50mL量筒,应选用15mL量筒最好.
分析 (1)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器,判断缺少的仪器;
(2)容量瓶是一种精密仪器,容积会随着温度的改变而改变,故不能盛放过热或者过冷的液体,不能溶解固体和稀释浓溶液,在使用前应查漏,据此分析;
(3)依据m=CVM计算需要溶质的质量;定容时仰视刻度线导致溶液体积偏大,依据C=$\frac{n}{V}$进行误差分析;
(4)依据C=$\frac{1000ρω}{M}$计算质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积,据此选择合适的量筒.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤:计算、称量或者量取、溶解或者稀释、移液、洗涤、定容等,用到的仪器:托盘天平和药匙或者量筒、烧杯、玻璃棒、容量瓶、胶头滴管;配制450mL溶液需要选择500mL容量瓶;
所以用不到的仪器:平底烧瓶和分液漏斗;还缺少的仪器:烧杯、玻璃棒、500mL容量瓶;
故答案为:A、C;烧杯、玻璃棒、500mL容量瓶;
(2)A.容量瓶带有活塞,使用前应检验容量瓶是否漏液,故A正确;
B.容量瓶用水洗净后,再用待配溶液洗涤,导致溶质的物质的量偏大,溶液浓度偏高,故B错误;
C.容量瓶不能用来溶解固体,故C错误;
D.容量瓶不能用来稀释浓溶液,故D错误;
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀,故E正确.
故选:BCD;
(3)需要用0.1mol/L NaOH溶液450mL,实际应选择500mL容量瓶,配制500mL溶液,需要氢氧化钠的质量m=0.1mol/L×40g/mol×0.5L=2.0g;
在实验中其他操作均正确,若定容时仰视刻度线,导致溶液体积偏大,依据C=$\frac{n}{V}$可知溶液浓度偏小;
故答案为:2.0g;小于;
(4)质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积V,依据液稀释过程中溶质的物质的量不变得V×18.4nol/L=0.5mol/L×500mL,解得V=13.6mL,需要选择15mL量筒;
故答案为:13.6;15;
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶的使用方法和注意事项,注意误差分析的方法.

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
| A. | FeCl3和FeCl2可以互换位置,对反应无影响 | |
| B. | 该电池总反应为FeCl3+Fe═2FeCl2 | |
| C. | 若溶解2.8g铁,约有0.1molCl-从交换膜左向右迁移 | |
| D. | 一段时间后,阴膜左、右侧离子数变化量之比约为2:3 |
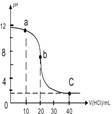
| A. | a点时,溶液呈碱性,溶液中c(B+)>c(Cl-) | |
| B. | b点时溶液的pH=7 | |
| C. | 当c(B+)=c(Cl-)时,v(HCl)<20mL | |
| D. | c点时溶液的c(H+)约为0.03mol•L-1 |
[Cu(H2O)4]2++4Cl-?[CuCl4]2-+4H2O
淡蓝色 黄绿色.
| A. | 加蒸馏水 | B. | 加浓盐酸 | C. | 加AgNO3溶液 | D. | 加氢氧化钠溶液 |
| A. | 氧化物 | B. | 酸 | C. | 碱 | D. | 盐 |
(1)叠氮化钠(NaN3)受撞击完成分解产生钠和氮气,故可应用于汽车安全气囊.若产生40.32L(标准状况下)氮气,至少需要叠氮化钠78g.
(2)钠-钾合金可在核反应堆中用作热交换液.5.05g钠-钾合金溶于200mL水生成0.075mol氢气.
①计算溶液中氢氧根离子的物质的量浓度0.75mol/L(忽略溶液体积变化).
②计算并确定该钠-钾合金的化学式NaK2.
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液.向该溶液中通入二氧化碳,有下列反应:2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O
已知通入二氧化碳336L(标准状况下),生成24mol Al(OH)3和15mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的 Al(OH)3和Na2CO3的物质的量之比为4:5
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |