题目内容
17.已知:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,现把19.2g Cu放入足量的稀硝酸中,微热至Cu完全反应.求:(1)写出Cu与稀硝酸的离子方程式.(2)生成的NO在标准状况下的体积.(3)被还原的硝酸的质量.分析 (1)Cu与稀硝酸发生反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(2)计算Cu的物质的量,根据方程式计算NO的体积;
(3)根据电子转移守恒计算被还原硝酸物质的量,再根据m=nM计算.
解答 解:(1)Cu与稀硝酸反应离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
答:Cu与稀硝酸反应离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)n(Cu)=$\frac{19.2g}{64g•mol}$=0.3mol,
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
3mol 44.8L
0.3mol V(NO)
所以V(NO)=$\frac{0.3mol×44.8L}{3mol}$=4.48L
答:标况下生成NO的体积为4.48L;
(3)根据电子转移守恒,被还原硝酸物质的量为$\frac{0.3mol×2}{5-2}$=0.2mol,则被还原硝酸的质量为0.2mol×63g/mol=12.6g
答:被还原硝酸的质量为12.6g.
点评 本题考查化学方程式计算、氧化还原反应计算、离子方程式书写,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
18.下列离子方程式正确的是( )
| A. | CH3COOH在水中电离:CH3COOH═H++CH3COO- | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+H+═HCO3ˉ | |
| C. | 大理石中加入稀盐酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | MgC12溶液与过量氨水反应:Mg2++2OH-═Mg(OH)2↓ |
19.某工厂用如图所示的流程图除去工业废气中含有的H2S,下列说法中正确的是( )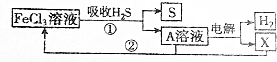

| A. | A溶液中溶质的成分为FeCl2 | B. | X为Cl2并且在阴极上生成的 | ||
| C. | 废气中的H2S最终转化为S和H2 | D. | 只有流程①为氧化还原反应 |
5.一般较强酸可制取较弱酸,这是复分解反应的规律之一.已知在常温下测得浓度均为0.1mol•L-1的下列6种溶液的pH:
(1)①请根据上述信息判断下列反应不能发生的是CE(填编号).
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
C.2HCN+Na2CO3═2NaCN+CO2+H2O
D.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
E.CO2+H2O+2NaClO═Na2CO3+2HClO
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-═B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为A->B2->HB-.
(2)一些复分解反应的发生还遵循其他规律.下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体.
根据上述反应,总结出复分解反应发生的另一规律为由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行.
(3)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9 mol•L-1,则该电解质可能是AD(填序号)
A.Na2S B.HCl C.K2SO4 D.NaOH E.CuSO4
(4)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.
①浓度为1.0×10-3 mol•L-1的氨水b L;
②c(OH-)=1.0×10-3 mol•L-1的氨水c L;
③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.
则a、b、c、d之间由大到小的顺序是:b>a=d>c.
(5)一定温度下,向等体积等物质的量浓度的下列三份溶液:①NaOH、②CH3COOH、③CH3COONa分别加等量水,pH变化最小的是③(填编号).一定温度下,向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1>n2(填“>”、“<”或“=”).
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
C.2HCN+Na2CO3═2NaCN+CO2+H2O
D.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
E.CO2+H2O+2NaClO═Na2CO3+2HClO
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-═B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为A->B2->HB-.
(2)一些复分解反应的发生还遵循其他规律.下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体.
根据上述反应,总结出复分解反应发生的另一规律为由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行.
(3)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9 mol•L-1,则该电解质可能是AD(填序号)
A.Na2S B.HCl C.K2SO4 D.NaOH E.CuSO4
(4)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.
①浓度为1.0×10-3 mol•L-1的氨水b L;
②c(OH-)=1.0×10-3 mol•L-1的氨水c L;
③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.
则a、b、c、d之间由大到小的顺序是:b>a=d>c.
(5)一定温度下,向等体积等物质的量浓度的下列三份溶液:①NaOH、②CH3COOH、③CH3COONa分别加等量水,pH变化最小的是③(填编号).一定温度下,向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1>n2(填“>”、“<”或“=”).
2.下列说法不正确的是( )
| A. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,不可制得Fe(OH)3胶体 | |
| B. | 胶体与其他分散系的本质区别是胶体能发生丁达尔效应 | |
| C. | 用半透膜分离淀粉和食盐的混合液 | |
| D. | Fe(OH)3胶体逐渐加入稀硫酸,会产生沉淀而后溶解 |
9.下列物质中,属于天然高分子化合物的是( )
| A. | 塑料制品 | B. | 天然油脂 | C. | 棉花 | D. | 人造橡胶 |
6.下列描述及热化学方程式均正确的是( )
| A. | 已知C2H6的燃烧热为1090 kJ•mol-1,则C2H6燃烧的热化学方程式为:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 25℃,101kPa下,l mol C6H6燃烧生成CO2和液态水时放出3260 kJ热量,其热化学方程式为:C6H6(g)+7.5O2(g)=6CO2(g)+3H2O (l)△H=-3260kJ•mol-1 | |
| C. | 已知常温下:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 | |
| D. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热△H=-283 kJ•mol-1 |
7.原予序数依次增大的四种短周期元素X、Y、Z、W,X元素组成的单质在自然界中硬度最大,Y元素的原子最外层电子数是次外层电子数的三倍,W元素与Y元素组成的化合物既能与酸反应又能与碱反应,Z元素的原子最外层只有一个电子.下列叙述错误的是( )
| A. | 元素金属性:Z>W | |
| B. | X与Y可形成多种共价化合物 | |
| C. | 化合物Z2Y2中既含离子键,又含共价键 | |
| D. | Y元素只能形成一种单质 |
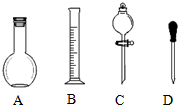 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.