题目内容
13.次磷酸(H3PO2)是一种二元强酸,常温下Ka=5.9×10-2具有较强的还原性,H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银.请回答下列间题:(1)请写出H3PO2的电离方程式:H3PO2?H++H2PO2-.
(2)常温下,NaH2PO2溶液显碱性(填“酸性”、“中性”或“碱性”).往NaH2PO2溶液中加入一定量的H3PO2溶液,若溶液的pH=2,则该溶液中c(H2PO2-):c(H3PO2)=5.9.若溶液H2PO2-和Na+浓度相等,则溶液显中性(填“酸性”、“中性”或“碱性”).
分析 (1)H3PO2是一元中强酸,电离是可逆的;
(2)NaH2PO2在溶液中水解显碱性;根据Ka=$\frac{c({H}_{2}P{{O}_{2}}^{-})•c({H}^{+})}{c({H}_{3}P{O}_{2})}$计算;根据电荷守恒分析.
解答 解:(1)H3PO2是一元中强酸,电离是可逆的,电离方程式为:H3PO2?H++H2PO2-,
故答案为:H3PO2?H++H2PO2-;
(2)NaH2PO2属于强碱弱酸盐,在溶液中水解显碱性;往NaH2PO2溶液中加入一定量的H3PO2溶液,若溶液的pH=2,即c(H+)=0.01mol/L,Ka=$\frac{c({H}_{2}P{{O}_{2}}^{-})•c({H}^{+})}{c({H}_{3}P{O}_{2})}$=$\frac{c({H}_{2}P{{O}_{2}}^{-})×0.01}{c({H}_{3}P{O}_{2})}$=5.9×10-2,所以c(H2PO2-):c(H3PO2)=5.9;
若溶液H2PO2-和Na+浓度相等,由电荷守恒为c(H2PO2-)+c(OH-)=c(Na+)+c(H+)可知,c(OH-)=c(H+),即溶液显中性;
故答案为:碱性;5.9;中性.
点评 本题考查电离方程式的书写、盐类水解、电离常数的有关计算等知识点,明确电离方程式书写规则、盐类水解原理解答即可,题目难度不大.

练习册系列答案
相关题目
4.在4FeO42-+20H+═4Fe3++3O2↑+10□反应中,下列说法正确的是( )
| A. | FeO42- 只做氧化剂 | |
| B. | O2是还原产物 | |
| C. | □处对应的物质是H2O | |
| D. | 若10 mol H+参加反应,转移的电子的物质的量是10 mol |
8.在常温、常压下,将10mL某气态烃与80mL氧气(过量)的混合物点燃燃烧,当恢复到原来的状况时,测得气体的体积为60mL,则该气态烃的化学式可能是( )
| A. | C3H8 | B. | C8H16 | C. | C8H8 | D. | C3H4 |
18.下列离子方程式正确的是( )
| A. | CH3COOH在水中电离:CH3COOH═H++CH3COO- | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+H+═HCO3ˉ | |
| C. | 大理石中加入稀盐酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | MgC12溶液与过量氨水反应:Mg2++2OH-═Mg(OH)2↓ |
5.海带中含碘元素,有人设计如下步骤来提取碘:①通适量Cl2;②将海带烧成灰,向灰中加水搅拌;③加CCl4振荡;④过滤;⑤用分液漏斗分液.正确的步骤顺序是( )
| A. | ①③⑤②④ | B. | ②④③①⑤ | C. | ③①②⑤④ | D. | ②④①③⑤ |
2.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 200mL 1mol•L-1Fe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA | |
| B. | 室温下,pH=13的NaOH溶液中含OH-数目为NA | |
| C. | 室温下,1L pH=12的Ba(OH)2溶液中OH-数目为0.2NA | |
| D. | 室温下,1L pH=1的盐酸中,由水电离的H+数目为10-13NA |
 ,B
,B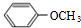 ,C
,C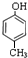 .
.
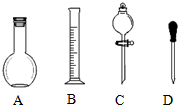 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.