题目内容
1.分类思想以及用分类思想研究一类物质的通性和特殊性是学习化学的一种重要思维方式和手段.以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图.请根据你所学的知识,按要求填空: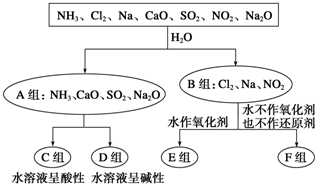
(1)上述第一级分类标准(分成A、B组的依据)是是否发生氧化还原反应.
(2)F组中物质除了Cl2外还有NO2(填化学式).
(3)D组中的氨水呈弱碱性,用电离方程式表示其呈弱碱性的原因:NH3•H2O?NH4++OH-.
(4)由Al3+制备Al(OH)3,最好不选择D组中的NaOH溶液,用离子方程式说明理由:Al(OH)3+OH-=AlO2-+2H2O.
(5)FeCl3的水溶液滴入沸水可得到以Fe(OH)3为分散质的红褐色胶体
①该红褐色胶体中Z(OH)3粒子的直径大小范围是1~100 nm.
②FeCl3溶液滴入沸水可得到Fe(OH)3红褐色胶体的反应的离子方程式是Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+.
分析 (1)依据图表变化和物质分类分析变化判断;
(2)F组与水反应时,水既不是氧化剂又不是还原剂,结合三种物质与水反应的特点判断.
(3)一水合氨电离出氢氧根离子而使其溶液呈碱性;
(4)氢氧化铝是两性氢氧化物溶于强酸强碱;
(5)FeCl3的水溶液滴入沸水可得到以Fe(OH)3胶体,胶体分散质的直径大小范围是1~100 nm,据此回答.
解答 解:(1)A组中物质与水发生反应,元素的化合价没有发生变化,不是氧化还原反应,而B组中物质与水发生氧化还原反应,则A、B的分组从是否发生氧化还原反应的角度分类,
故答案为:是否发生氧化还原反应;
(2)F组与水反应时,水既不是氧化剂又不是还原剂,应为氯气、二氧化氮与水的反应,与水反应时发生反应的方程式为3NO2+H2O═2HNO3+NO,反应二氧化氮中氮元素化合价既升高也降低,二氧化氮既作氧化剂又作还原剂,故答案为:NO2;
(3)氨水呈弱碱性是因为一水合氨存在电离平衡电离出氢氧根离子,电离方程式为:NH3•H2O?NH4++OH-,故答案为:NH3•H2O?NH4++OH-;
(4)氢氧化铝是两性氢氧化物溶于强酸强碱,过量NaOH会溶解生成的沉淀,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;(5)①FeCl3的水溶液滴入沸水可得到以Fe(OH)3胶体,胶体分散质的直径大小范围是1~100 nm;故答案为:1~100 nm;
②FeCl3的水溶液滴入沸水可得到以Fe(OH)3胶体,生成Fe(OH)3胶体的离子方程式是Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,故答案为:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+.
点评 本题考查物质的分类和二氧化硫的化学性质以及热化学方程式的书写以及盖斯定律的应用知识,注意知识之间的联系,难度不大.

 出彩同步大试卷系列答案
出彩同步大试卷系列答案| A. | 200mL 1mol•L-1Fe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA | |
| B. | 室温下,pH=13的NaOH溶液中含OH-数目为NA | |
| C. | 室温下,1L pH=12的Ba(OH)2溶液中OH-数目为0.2NA | |
| D. | 室温下,1L pH=1的盐酸中,由水电离的H+数目为10-13NA |
| A. | 塑料制品 | B. | 天然油脂 | C. | 棉花 | D. | 人造橡胶 |
| A. | 紫色石蕊溶液 | B. | 石灰石粉末 | C. | 硝酸银溶液 | D. | 硫酸钠溶液 |
| A. | 已知C2H6的燃烧热为1090 kJ•mol-1,则C2H6燃烧的热化学方程式为:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 25℃,101kPa下,l mol C6H6燃烧生成CO2和液态水时放出3260 kJ热量,其热化学方程式为:C6H6(g)+7.5O2(g)=6CO2(g)+3H2O (l)△H=-3260kJ•mol-1 | |
| C. | 已知常温下:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 | |
| D. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热△H=-283 kJ•mol-1 |
| A. | 9.820g晶体中含有C2O42-的物质的量为0.006mol | |
| B. | 配制草酸合铁酸钾溶液玻璃仪器只需烧杯和玻璃棒 | |
| C. | 该晶体的化学式为K3Fe(C2O4)3•6H2O | |
| D. | 9.820g样品中含K+的物质的量为0.06 mol |
| A. | 3.0mol | B. | 2.5mol | C. | 1.0mol | D. | 0.75mol |
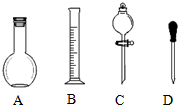 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.