题目内容
7.氯化铜的水溶液中存在下列可逆反应:下列方法能使蓝色的氯化铜溶液变成黄绿色的是( )[Cu(H2O)4]2++4Cl-?[CuCl4]2-+4H2O
淡蓝色 黄绿色.
| A. | 加蒸馏水 | B. | 加浓盐酸 | C. | 加AgNO3溶液 | D. | 加氢氧化钠溶液 |
分析 使蓝色的氯化铜溶液变成黄绿色的转化,采取的操作使溶液中[Cu(H2O)4]2+浓度减小,即使平衡向正反应方向移动,根据勒夏特列原理,只有通过增大Cl-浓度才能达到这种移动.
A、加蒸馏水稀释,溶液中离子浓度降低,平衡向生成[Cu(H2O)4]2+方向移动;
B、加入浓盐酸,溶液中Cl-浓度浓度增大,平衡正向进行,蓝色的氯化铜溶液变成黄绿色;
C、加入AgNO3溶液,银离子和氯离子结合生成氯化银沉淀,溶液中Cl-浓度浓度减小,平衡逆向进行;
D、加氢氧化钠溶液,产生氢氧化铜沉淀,溶液中Cu2+降低;
解答 解:使黄绿色CuCl2溶液向蓝色转化,采取的操作使溶液中[Cu(H2O)4]2+浓度增大,即使平衡向逆反应方向移动,根据勒夏特列原理,通过减小Cl-浓度才能达到这种移动.
A、加蒸馏水稀释,溶液中离子浓度降低,平衡向微粒数增大的方向进行,平衡向生成[Cu(H2O)4]2+方向移动,能使溶液黄绿色变成淡蓝色,故A错误;
B、加入浓盐酸,氯离子浓度增大,平衡向正反应方向移动,能使蓝色的氯化铜溶液变成黄绿色,故B正确;
C、加入AgNO3溶液,银离子和氯离子结合生成氯化银沉淀,溶液中Cl-浓度浓度减小,平衡逆向进行,使黄绿色氯化铜溶液向淡蓝色转化,故C错误;
D、加入NaOH溶液时,铜离子完全和氢氧化钠反应生成氢氧化铜蓝色沉淀,平衡逆向进行,所以溶液最终变浅或呈无色,故D错误;
故选B.
点评 本题考查平衡的移动影响因素,难度中等,改变一个条件,平衡向减弱这种改变的方向进行,改变条件,平衡可以正向进行或逆向进行,溶液颜色发生改变.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
8.在常温、常压下,将10mL某气态烃与80mL氧气(过量)的混合物点燃燃烧,当恢复到原来的状况时,测得气体的体积为60mL,则该气态烃的化学式可能是( )
| A. | C3H8 | B. | C8H16 | C. | C8H8 | D. | C3H4 |
9.升高温,下列溶液的pH不变的是( )
| A. | NaCl溶液 | B. | NaOH溶液 | C. | NaHSO3溶液 | D. | NaHSO4溶液 |
6.有一不饱和的K0H溶液,加入xmolK2O或ymolK2O2或zmolK0H,均恰好得到同温度下的饱和K0H溶液,则x、y、z的关系正确的是( )
| A. | z>y>x | B. | x=y>2z | C. | x=y<$\frac{z}{2}$ | D. | x=y>$\frac{z}{2}$ |
16.将氯水分别滴加到盛有下列物质的试管中,没有明显现象的是( )
| A. | 紫色石蕊溶液 | B. | 石灰石粉末 | C. | 硝酸银溶液 | D. | 硫酸钠溶液 |
17.下列陈述Ⅰ和Ⅱ均正确,并存在因果关系的是( )
| 陈述Ⅰ | 陈述Ⅱ | |
| A | BaSO4难溶于水 | SO2气体通入Ba(NO3)2溶液中沉淀 |
| B | 非金属性:Cl>S | 酸性:HClO3>H2SO4 |
| C | 常温下,NaHCO3的溶解度比Na2CO3小 | 向饱和Na2CO3溶液中通入CO2产生沉淀 |
| D | 常温下,SO2与氢硫酸和NaOH溶液均可反应 | SO2是两性氧化物 |
| A. | A | B. | B | C. | C | D. | D |

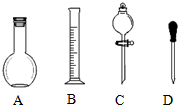 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题. .
.