题目内容
4.已知可逆反应2NO(g)?N2(g)+O2(g).若在某温度下达到平衡时c(N2)=0.05mol•L-1,c(O2)=0.05mol•L-1,c(NO)=0.1mol•L-1 该反应的平衡常数为0.25.保持温度不变,将容器体积缩小一半,则平衡常数不变(填增大、减小或不变).分析 K为生成物浓度幂之积与反应物浓度幂之积的比,且K与温度有关,与压强、浓度无关,以此来解答.
解答 解:平衡时c(N2)=0.05mol•L-1,c(O2)=0.05mol•L-1,c(NO)=0.1mol•L-1,则K=$\frac{0.05×0.05}{0.{1}^{2}}$=0.25,保持温度不变,将容器体积缩小一半,则平衡常数不变,
故答案为:0.25;不变.
点评 本题考查化学平衡的计算,为高频考点,把握K与平衡浓度的关系、K与温度的关系为解答的关键,侧重分析与计算能力的考查,注意K的影响因素,题目难度不大.

练习册系列答案
相关题目
7.按如图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )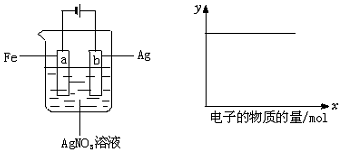
(1)c(Ag+) (2)c(NO3-) (3)a棒的质量 (4)b棒的质量 (5)溶液的pH.

(1)c(Ag+) (2)c(NO3-) (3)a棒的质量 (4)b棒的质量 (5)溶液的pH.
| A. | (1)(2) | B. | (3)(4) | C. | (1)(2)(4) | D. | (1)(2)(5) |
5.下列离子方程式正确的是( )
| A. | Zn与稀H2SO4反应:2Zn+2H+═2Zn2++H2↑ | |
| B. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+ | |
| D. | 硫酸氢钠溶液与过量氢氧化钡溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
12. 己知反应:2Al(l) $\stackrel{催化剂}{?}$B(l)△H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示.下列说法正确的是( )
己知反应:2Al(l) $\stackrel{催化剂}{?}$B(l)△H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示.下列说法正确的是( )
 己知反应:2Al(l) $\stackrel{催化剂}{?}$B(l)△H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示.下列说法正确的是( )
己知反应:2Al(l) $\stackrel{催化剂}{?}$B(l)△H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示.下列说法正确的是( )| A. | a代表20℃下A的Y-t曲线 | |
| B. | 反应到66min时,0℃和20℃下反应放出的热量相等 | |
| C. | 0℃和20℃下达到平衡时,反应都放出QkJ热量 | |
| D. | 反应都达到平衡后,正反应速率a>b |
9.将9g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为( )
| A. | 8g | B. | 9g | C. | 12g | D. | 13.5g |
13.可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图.下列叙述正确的是( )
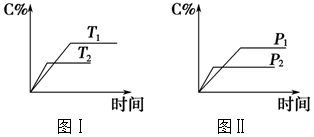

| A. | 化学方程式中m+n<e+f | |
| B. | 达平衡后,若升温,平衡左移 | |
| C. | 达平衡后,加入催化剂则C%增大 | |
| D. | 达平衡后,增加A的量有利于平衡向右移动 |
 实验室某浓硫酸的试剂瓶上的标签如右图所示,根据标签上的有关数据回答下列问题:
实验室某浓硫酸的试剂瓶上的标签如右图所示,根据标签上的有关数据回答下列问题: