题目内容
9.将9g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为( )| A. | 8g | B. | 9g | C. | 12g | D. | 13.5g |
分析 CO在氧气中完全燃烧生成CO2,CO2和再与Na2O2反应,方程式为2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2、2CO2+2Na2O2=2Na2CO3+O2,总方程式为:CO+Na2O2=Na2CO3,可知过氧化钠增重为CO的质量;
H2在氧气中完全燃烧生成H2O,H2O再与Na2O2反应,方程式为2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O、2H2O+2Na2O2=4NaOH+O2,总反应方程式为:H2+Na2O2=2NaOH,可知反应后固体质量增加为氢气质量,以此解答该题.
解答 解:由CO在氧气中完全燃烧生成CO2,CO2和再与Na2O2反应,方程式为2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2、2CO2+2Na2O2=2Na2CO3+O2,总方程式为:CO+Na2O2=Na2CO3,可知过氧化钠增重为CO的质量;
H2在氧气中完全燃烧生成H2O,H2O再与Na2O2反应,方程式为2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O、2H2O+2Na2O2=4NaOH+O2,总反应方程式为:H2+Na2O2=2NaOH,可知反应后固体质量增加为氢气质量,
则9g由CO和H2组成的混合气体,最终Na2O2固体增加的质量为9g,
故选B.
点评 本题考查混合物计算,为高频考点,注意利用总反应方程式判断固体增重,也可以利用差量法进行判断,若物质可以写成(CO)x.(H2)y形式,完全燃烧后通入足量过氧化钠,过氧化钠增重为该物质的质量,侧重于学生的分析能力和计算能力的考查,题目难度中等.

练习册系列答案
相关题目
12.下列反应中,属于非氧化还原反应的是( )
| A. | 3CuS+8HNO3═3Cu(NO3)2+2NO↑+3S↓+4H2O | |
| B. | Br2+2KOH═KBr+KBrO+H2O | |
| C. | 3H2O2+2KCrO2+2KOH═2K2CrO4+4H2O | |
| D. | 3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2+2KCl |
13.四氯化钛(TiCl4)是制取航天工业材料--钛合金的重要原料.实验室以TiO2和CCl4为原料制取液态TiCl4的装置如图所示(部分夹持装置省略).

已知:有关物质的性质如表:
请回答下列问题:
(1)仪器A的名称是球形干燥管,仪器A中盛装的试剂是碱石灰或生石灰、氢氧化钠,氯化钙等.
(2)CCl4的电子式为 .
.
(3)装置C处硬质玻管中反应的化学方程式为TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g).
(4)TiCl4遇潮湿空气会产生TiO2,反应的化学方程式为TiCl4+2H2O=TiO2+4HCl.
(5)仪器N中收集到的物质主要有CCl4、TiCl4(写化学式),从产物中分离出TiCl4的实验方法是蒸馏.
(6)TiCl4还可由TiO2、焦炭和氯气在加热条件下制得,生成体积比为2:1的CO和CO2混合气体,该感应中氧化剂与还原剂的物质的量之比为4:3.请设计实验方案验证产物气体中有CO:将产物气体依序通入足量的NaOH溶液→干燥剂→灼热的CuO→澄清石灰水,若最终澄清石灰水变浑浊,灼热的CuO固体由黑色变红色,则产物中有CO.

已知:有关物质的性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,在550℃时能被氧气氧化 |
(1)仪器A的名称是球形干燥管,仪器A中盛装的试剂是碱石灰或生石灰、氢氧化钠,氯化钙等.
(2)CCl4的电子式为
 .
.(3)装置C处硬质玻管中反应的化学方程式为TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g).
(4)TiCl4遇潮湿空气会产生TiO2,反应的化学方程式为TiCl4+2H2O=TiO2+4HCl.
(5)仪器N中收集到的物质主要有CCl4、TiCl4(写化学式),从产物中分离出TiCl4的实验方法是蒸馏.
(6)TiCl4还可由TiO2、焦炭和氯气在加热条件下制得,生成体积比为2:1的CO和CO2混合气体,该感应中氧化剂与还原剂的物质的量之比为4:3.请设计实验方案验证产物气体中有CO:将产物气体依序通入足量的NaOH溶液→干燥剂→灼热的CuO→澄清石灰水,若最终澄清石灰水变浑浊,灼热的CuO固体由黑色变红色,则产物中有CO.
10.下列说法正确的是( )
| A. | 相同体积、相同浓度的氨水和NaOH溶液中和盐酸的能力相同 | |
| B. | 醋酸溶液中只存在一个电离平衡体系 | |
| C. | 0.1mol•L-1的氨水能使酚酞试液变红,说明氨水是弱电解质水溶液 | |
| D. | 同浓度同体积的醋酸和盐酸分别与足量镁反应时,放出H2的速率相同 |
1.空气是人类生存所必须的重要资源.下列措施不利于建设“蓝天工程”的是( )
| A. | 严禁露天焚烧农作物秸秆 | |
| B. | 加强植树造林,增大绿化面积 | |
| C. | 大力推行汽车使用天然气或氢气为燃料 | |
| D. | 生产生活中加大煤炭和石油等燃料的使用量 |
18.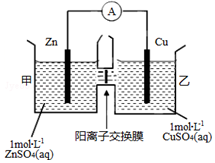 锌铜原电池装置如图所示,中间被阳离子交换膜隔开且只允许阳离子和水分子通过,下列有关叙述正确的是( )
锌铜原电池装置如图所示,中间被阳离子交换膜隔开且只允许阳离子和水分子通过,下列有关叙述正确的是( )
 锌铜原电池装置如图所示,中间被阳离子交换膜隔开且只允许阳离子和水分子通过,下列有关叙述正确的是( )
锌铜原电池装置如图所示,中间被阳离子交换膜隔开且只允许阳离子和水分子通过,下列有关叙述正确的是( )| A. | 铜电极上发生氧化反应 | |
| B. | 外电路中电子由Cu流向Zn | |
| C. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| D. | 电池工作一段时间后,甲池的C(SO42-)增大 |
19.下列叙述中,不能说明醋酸是弱电解质的是( )
| A. | CH3COONa溶液显碱性 | |
| B. | CH3COOH能与氨水发生中和反应 | |
| C. | 室温下,0.1mol/L的CH3COOH溶液的PH为3 | |
| D. | 相同条件下,等浓度的醋酸溶液的导电能力比盐酸弱 |