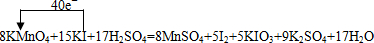题目内容
8.现有8种元素的性质、数据如表所列,它们属于第二或第三周期.| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)①在元素周期表中的位置是第二周期VIA.写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物属于离子化合物(填“离子”或“共价”).
(3)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
分析 由元素的性质可知,①只有-2价,则①为O;④、⑦中化合价相同,半径不同,则④为P,⑦为N;⑤为Cl,结合原子半径可知,②为Mg,③为Li,⑥为Na,⑧为B,以此来解答.
解答 解:由元素的性质可知,①只有-2价,则①为O;④、⑦中化合价相同,半径不同,则④为P,⑦为N;⑤为Cl结合原子半径可知,②为Mg,③为Li,⑥为Na,⑧为B,
(1)①在元素周期表中的位置是第二周期VIA,②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O,
故答案为:第二周期VIA;Mg(OH)2+2H+=Mg2++2H2O;
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物为NaOH,属于离子化合物,故答案为:HClO4;离子;
(3)非金属性N>P,则④和⑦的氢化物的稳定性为NH3>PH3,故答案为:NH3>PH3.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质推断元素、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
4.MgSO4和Al2(SO4)3溶液等体积混合后,Al3+浓度为0.1mol/L.SO42-浓度为0.3mol/L,则混合溶液中Mg2+浓度为( )
| A. | 0.15mol/L | B. | 0.3mol/L | C. | 0.45mol/L | D. | 0.2mol/L |
13.配制1mol/LNaCl溶液时,造成最终浓度偏低的原因可能是( )
| A. | 容量瓶事先没有烘干 | B. | 定容时观察液面俯视 | ||
| C. | 定容时观察液面仰视 | D. | 定容后,摇匀时有少量液体流出 |
20.在某碱性溶液中,能共存的离子组是( )
| A. | Na+、Ba2+、Cl-、NO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、HCO3- | D. | Al3+、K+、SO42-、Cl- |
18.利用电化学原理保护钢闸门的某装置如图所示,关于该装置的说法正确的是( )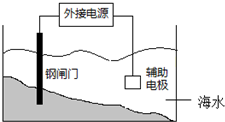

| A. | 钢闸门应与外接电源的负极相连 | |
| B. | 该装置的原理是“牺牲阳极阴极保护法” | |
| C. | 辅助电极材料可用锌 | |
| D. | 阴极的电极反应式:2Cl--2e→Cl2↑ |
 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:



 .
. ,C中含有的含氧官能团的名称为硝基和羧基.
,C中含有的含氧官能团的名称为硝基和羧基. .
. (任写一种).
(任写一种).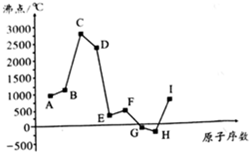 如图是周期表中原子序数小于20的某些元素的单质的沸点与原子序数的关系,图中的原子序数是连续的.
如图是周期表中原子序数小于20的某些元素的单质的沸点与原子序数的关系,图中的原子序数是连续的.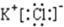 (写电子式).
(写电子式).