题目内容
13.配制1mol/LNaCl溶液时,造成最终浓度偏低的原因可能是( )| A. | 容量瓶事先没有烘干 | B. | 定容时观察液面俯视 | ||
| C. | 定容时观察液面仰视 | D. | 定容后,摇匀时有少量液体流出 |
分析 分析操作对溶质物质的量、溶液体积的影响,根据c=$\frac{n}{V}$判断对所配溶液浓度的影响.
解答 解:A.容量瓶事先没有烘干,最终溶液体积不变,所配溶液浓度不变,故A错误;
B.定容时观察液面俯视,导致溶液体积偏小,所配溶液浓度偏大,故B错误;
C.定容时观察液面仰视,导致溶液体积偏大,所配溶液浓度偏小,故C正确;
D.定容后,摇匀时有少量液体流出,导致溶质的物质的量偏小,所配溶液浓度偏小,故D正确;
故选CD.
点评 本题考查了一定物质的量浓度溶液的误差分析,根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响是解题的关键.

练习册系列答案
相关题目
4.下列图示与内容不相吻合的是( )
| A. |  闻氯气的气味 | B. |  用排饱和食盐水法收集氯气 | ||
| C. |  盛装液氯的容器 | D. |  证明氯气可以与NaOH溶液反应 |
8.现有8种元素的性质、数据如表所列,它们属于第二或第三周期.
回答下列问题:
(1)①在元素周期表中的位置是第二周期VIA.写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物属于离子化合物(填“离子”或“共价”).
(3)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)①在元素周期表中的位置是第二周期VIA.写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物属于离子化合物(填“离子”或“共价”).
(3)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
5.下列说法中正确的是( )
| A. | 元素周期表中元素排序的依据是元素的相对原子质量 | |
| B. | 在金属元素和非金属元素分界线,可以找到半导体材料 | |
| C. | 元素周期表有十六个族,也就有十六个纵行 | |
| D. | 元素周期表已发展成为一个稳定的形式,它不可能再有任何新的变化了 |
2.实验室从含溴化氢的废液中提取溴单质,下列步骤中的实验装置正确的是( )
| A. | 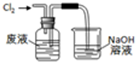 氧化废液中的溴化氢 | B. |  分离CCl4层和水层 | ||
| C. | 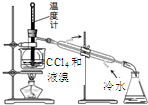 分离四氯化碳和液溴 | D. | 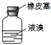 储存液溴 |
3.β-月桂烯的结构如图 所示,一分子该物质与溴发生加成反应,得到的产物(只考虑位置异构)理论上最多有( )
所示,一分子该物质与溴发生加成反应,得到的产物(只考虑位置异构)理论上最多有( )
 所示,一分子该物质与溴发生加成反应,得到的产物(只考虑位置异构)理论上最多有( )
所示,一分子该物质与溴发生加成反应,得到的产物(只考虑位置异构)理论上最多有( )| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |