题目内容
4.MgSO4和Al2(SO4)3溶液等体积混合后,Al3+浓度为0.1mol/L.SO42-浓度为0.3mol/L,则混合溶液中Mg2+浓度为( )| A. | 0.15mol/L | B. | 0.3mol/L | C. | 0.45mol/L | D. | 0.2mol/L |
分析 混合溶液中存在电荷守恒,即3c(Al3+)+2c(Mg2+)=2c(SO42-),溶液中H+、OH-离子浓度较小,可忽略不计,以此解答该题.
解答 解:MgSO4和Al2(SO4)3溶液等体积混合后,溶液中存在电荷守恒,即3c(Al3+)+2c(Mg2+)=2c(SO42-),
则c(Mg2+)=$\frac{2×0.3mol/L-3×0.1mol/L}{2}$=0.15mol/L.
故选A.
点评 本题考查物质的量浓度的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握相关计算公式的运用,从电荷守恒的角度解答该题,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.能够用来检验酒精中是否含有水的试剂是( )
| A. | 金属钠 | B. | 无水硫酸铜 | C. | 无水氯化钙 | D. | 浓硫酸 |
15.已知碳碳单键可以绕键轴旋转,某烃的结构简式为: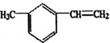 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A. | 分子中所有碳原子可能处于同一平面上 | |
| B. | 分子中至少有7个碳原子一定处于同一平面上 | |
| C. | 分子中所有原子有可能处于同一平面上 | |
| D. | 分子中至多有16个原子处于同一平面上 |
12.下列各组离子能大量共存于同一溶液的是( )
| A. | Fe3+、NH${\;}_{4}^{+}$、Br-、I- | B. | Fe2+、H+、NO3-、Cl- | ||
| C. | Fe3+、H+、SO42-、Br- | D. | Fe3+、Ca2+、NO3-、SO42-、 |
19.有K2SO4和Al2(SO4)3的混合溶液,已知其中K+的物质的量浓度为0.2mol/L,SO42-的物质浓度为0.7mol/L,则此溶液中Al3+的物质的量的浓度为( )
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
8.现有8种元素的性质、数据如表所列,它们属于第二或第三周期.
回答下列问题:
(1)①在元素周期表中的位置是第二周期VIA.写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物属于离子化合物(填“离子”或“共价”).
(3)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)①在元素周期表中的位置是第二周期VIA.写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物属于离子化合物(填“离子”或“共价”).
(3)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
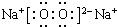 ,其中含有的化学键是离子键、共价键.
,其中含有的化学键是离子键、共价键.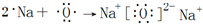 .
.


 上四 个碳原子各连接1个支链或取代基.
上四 个碳原子各连接1个支链或取代基.