题目内容
17.A、B、C、D 4种元素的核电荷数依次增大,它们的离子的电子层数相同且最外层电子数均为8.A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于电子总数的一半.请回答下列问题:
(1)4种元素的符号依次是AS,BCl,CK,DCa.它们原子的半径由大到小的顺序是(要求写出化学符号)K>Ca>S>Cl.
(2)C和D元素对应的最高价氧化物对应水化物的碱性强弱顺序(要求写出化学式)KOH>Ca(OH)2.
分析 A原子的L层电子数与K、M层电子数之和相等,则A的K、L、M层电子分别为2、8、6,即A为S;D原子的K、L层电子数之和等于电子总数的一半,则D的质子数为10×2=20,则D为Ca,A、B、C、D 4种元素的核电荷数依次增大,它们的离子的电子层数相同且最外层电子数均为8,可知B为Cl,C为K,以此来解答.
解答 解:A原子的L层电子数与K、M层电子数之和相等,则A的K、L、M层电子分别为2、8、6,即A为S;D原子的K、L层电子数之和等于电子总数的一半,则D的质子数为10×2=20,则D为Ca,A、B、C、D 4种元素的核电荷数依次增大,它们的离子的电子层数相同且最外层电子数均为8,可知B为Cl,C为K,
(1)由上述分析可知,A为S,B为Cl,C为K,D为Ca,电子层越多,原子半径越大,同周期原子序数大的离子半径小,原子半径由大到小的顺序为K>Ca>S>Cl,
故答案为:S;Cl;K;Ca;K>Ca>S>Cl;
(2)金属性K>Ca,则C和D元素对应的最高价氧化物对应水化物的碱性强弱顺序为KOH>Ca(OH)2,故答案为:KOH>Ca(OH)2.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子的电子排布、离子结构推断元素为解答的关键,侧重分析与应用能力的考查,注意18电子微粒的应用,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
8.现有8种元素的性质、数据如表所列,它们属于第二或第三周期.
回答下列问题:
(1)①在元素周期表中的位置是第二周期VIA.写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物属于离子化合物(填“离子”或“共价”).
(3)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)①在元素周期表中的位置是第二周期VIA.写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物属于离子化合物(填“离子”或“共价”).
(3)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
5.下列说法中正确的是( )
| A. | 元素周期表中元素排序的依据是元素的相对原子质量 | |
| B. | 在金属元素和非金属元素分界线,可以找到半导体材料 | |
| C. | 元素周期表有十六个族,也就有十六个纵行 | |
| D. | 元素周期表已发展成为一个稳定的形式,它不可能再有任何新的变化了 |
12.现有8种元素的性质、数据如下表所列,它们属于第二或第三周期.
回答下列问题:
(1)③的元素符号是Be,①的元素名称是氧.
(2)在这8种元素的最高价氧化物的水化物中,酸性最强的化合物的名称是高氯酸.②与⑤形成的化合物的电子式是: ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).
(3)比较④和⑦的氢化物的稳定性(用分子式表示)NH3>PH3.
(4)写出⑥最高价氧化物对应水化物跟⑧的最高价氧化物反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
(5)请设计实验比较单质②⑧的金属性,写出简单的实验步骤和现象:取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,镁与盐酸反应比铝剧烈.
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 0.89 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +2 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)③的元素符号是Be,①的元素名称是氧.
(2)在这8种元素的最高价氧化物的水化物中,酸性最强的化合物的名称是高氯酸.②与⑤形成的化合物的电子式是:
 ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).(3)比较④和⑦的氢化物的稳定性(用分子式表示)NH3>PH3.
(4)写出⑥最高价氧化物对应水化物跟⑧的最高价氧化物反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
(5)请设计实验比较单质②⑧的金属性,写出简单的实验步骤和现象:取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,镁与盐酸反应比铝剧烈.
2.实验室从含溴化氢的废液中提取溴单质,下列步骤中的实验装置正确的是( )
| A. | 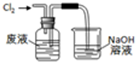 氧化废液中的溴化氢 | B. |  分离CCl4层和水层 | ||
| C. | 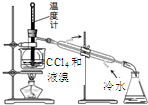 分离四氯化碳和液溴 | D. |  储存液溴 |
6.向一定量的饱和石灰水中不断通入二氧化碳,其溶液质量变化是( )
| A. | 变小 | B. | 变大 | C. | 先变大后变小 | D. | 先变小后变大 |
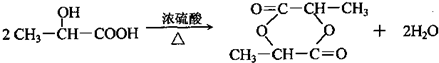


 上四 个碳原子各连接1个支链或取代基.
上四 个碳原子各连接1个支链或取代基. X、Y、Z、Q、R为原子序数依次增大的前四周期元素.X的一种1﹕2型氢化物分子中既有σ键又有π键,且分子中所有原子共平面;Z的L层有2个未成对电子;Q是所在周期中电负性最大的元素,QZ2可替代Q2作新的自来水消毒剂;R在周期表中位于d区,其基态原子有两个能级处于半充满状态.
X、Y、Z、Q、R为原子序数依次增大的前四周期元素.X的一种1﹕2型氢化物分子中既有σ键又有π键,且分子中所有原子共平面;Z的L层有2个未成对电子;Q是所在周期中电负性最大的元素,QZ2可替代Q2作新的自来水消毒剂;R在周期表中位于d区,其基态原子有两个能级处于半充满状态.