题目内容
下面有关晶体的叙述中,不正确的是( )
| A、金刚石为空间网状结构,由共价键形成的碳原子环上,最小的环上有6个碳原子 |
| B、氯化钠晶体中,每个Na+周围距离相等的Na+共有6个 |
| C、氯化铯晶体中,每个Cs+周围紧邻8个Cl- |
| D、干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
考点:离子晶体,分子晶体
专题:化学键与晶体结构
分析:A.金刚石晶体中,每个最小的环上含有6个碳原子;
B.氯化钠晶胞中,每个钠离子周围距离最近的钠离子是12个;
C.氯化铯晶体中,铯离子的配位数是8;
D.二氧化碳晶体中每个二氧化碳分子周围紧邻12个二氧化碳分子.
B.氯化钠晶胞中,每个钠离子周围距离最近的钠离子是12个;
C.氯化铯晶体中,铯离子的配位数是8;
D.二氧化碳晶体中每个二氧化碳分子周围紧邻12个二氧化碳分子.
解答:
解:A.金刚石网状结构中,每个碳原子含有4个共价键,由共价键形成的碳原子环中,最小的环上有6个碳原子,故A正确;
B.氯化钠晶胞中,每个钠离子周围距离最近的钠离子个数=3×8÷2=12,故B错误;
C.氯化铯晶体中,铯离子的配位数是8,故C正确;
D.二氧化碳晶体属于面心立方,每个二氧化碳分子周围紧邻二氧化碳分子个数=3×8÷2=12,故D正确.
故选B.
B.氯化钠晶胞中,每个钠离子周围距离最近的钠离子个数=3×8÷2=12,故B错误;
C.氯化铯晶体中,铯离子的配位数是8,故C正确;
D.二氧化碳晶体属于面心立方,每个二氧化碳分子周围紧邻二氧化碳分子个数=3×8÷2=12,故D正确.
故选B.
点评:本题考查了晶体的空间结构,明确典型的晶体类型、结构、晶胞为解答本题关键,同时要求学生有丰富的空间想象能力,难度较大.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
把0.02mol?L-1 CH3COOH溶液和0.01mol?L-1 NaOH溶液以等体积混合,混合溶液中粒子浓度关系正确的是( )
| A、c(CH3COO-)>c(Na+) |
| B、c(CH3COOH)>c(CH3COO-) |
| C、c(H+)<c(OH-) |
| D、c(CH3COO-)>+c(CH3COOH)=0.02mol?L-1 |
1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能.下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是( )
| A、Na+(g)+Cl-(g)═NaCl(s)△H |
| B、Na(s)+12Cl2(g)═NaCl(s)△H1 |
| C、Na(g)-e-═Na+(g)△H2 |
| D、Cl(g)+e-═Cl-(g)△H3 |
环境污染问题越来越受到人们的关注,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的.下列环境问题与所对应的物质不相关的是( )
| A、温室效应--二氧化碳 |
| B、光化学污染--二氧化氮 |
| C、酸雨--二氧化碳 |
| D、臭氧层破坏--氟氯烃 |
两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n.下列说法错误的是( )
| A、若a=b=3,8>m>n>b,则元素非金属性:X>Y |
| B、若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y<X |
| C、若Y的气态氢化物化学式为YHn,且b<4,则该氢化物易溶于水 |
| D、若a<b=3,m=n=7,已知原子半径大小:Y>N(氮原子)>X,则NX3、NY3与水反应生成不同的含氮化合物 |
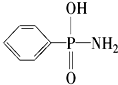 ,在P-N键中,你认为共用电子对偏向
,在P-N键中,你认为共用电子对偏向