题目内容
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
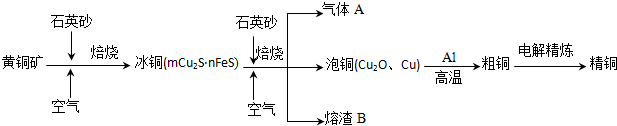
(1)气体A中的大气污染物可选用下列试剂中的 吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,检验溶液中是否含有Fe3+的试剂是 .若检验溶液中还存在Fe2+,所用试剂是 . 己知:Ksp[Fe(OH)3]=4.0×10-38,若所得溶液中只含Fe3+,在溶液中加入一定量的石灰水,调节溶液的pH为5,此时Fe3+的浓度
(3)由泡铜冶炼粗铜的化学反应方程式为 .
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 .
a.CuSO4溶液的浓度不变b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属精炼后电解质溶液中的阳离子有: .

(1)气体A中的大气污染物可选用下列试剂中的
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,检验溶液中是否含有Fe3+的试剂是
(3)由泡铜冶炼粗铜的化学反应方程式为
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
a.CuSO4溶液的浓度不变b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属精炼后电解质溶液中的阳离子有:
考点:铜金属及其重要化合物的主要性质,铜的电解精炼,难溶电解质的溶解平衡及沉淀转化的本质
专题:电化学专题,几种重要的金属及其化合物
分析:(1)由流程图转化可知,气体A中的大气污染物主要是二氧化硫,选择试剂吸收二氧化硫,不能产生新的污染气体,二氧化硫是酸性氧化物,结合选项中各物质的性质判断;
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明含有Fe3+;Fe2+具有还原性,可以利用KMnO4溶液检验;根据Ksp[Fe(OH)3]=C(Fe3+)C(OH-)3进行计算;
(3)由流程图转化可知,Cu2O与Al反应置换反应生成Al2O3与Cu;
(4)a、精炼铜时,粗铜做阳极,精铜作阴极,CuSO4溶液作电解质溶液,电解过程中由于粗铜中有比铜活泼的杂质,所以当这些杂质溶解时,阴极析出的仍然是铜,所以CuSO4溶液的浓度变小;
b、精炼铜时,粗铜做阳极,与电源正极相连发生氧化反应;
c、溶液中Cu2+向阴极移动;
d、Ag、Pt、Au不如铜活泼,铜放电后Ag、Pt、Au从粗铜脱落;
(5)精炼铜时,粗铜做阳极,精铜作阴极,CuSO4溶液作电解质溶液,电解过程中由于粗铜中有比铜活泼的杂质,铝和锌都先失电子进入溶液,而阴极析出的仍然是铜,所以精炼后电解质溶液中的阳离子有Al3+、Zn2+、Cu2+.
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明含有Fe3+;Fe2+具有还原性,可以利用KMnO4溶液检验;根据Ksp[Fe(OH)3]=C(Fe3+)C(OH-)3进行计算;
(3)由流程图转化可知,Cu2O与Al反应置换反应生成Al2O3与Cu;
(4)a、精炼铜时,粗铜做阳极,精铜作阴极,CuSO4溶液作电解质溶液,电解过程中由于粗铜中有比铜活泼的杂质,所以当这些杂质溶解时,阴极析出的仍然是铜,所以CuSO4溶液的浓度变小;
b、精炼铜时,粗铜做阳极,与电源正极相连发生氧化反应;
c、溶液中Cu2+向阴极移动;
d、Ag、Pt、Au不如铜活泼,铜放电后Ag、Pt、Au从粗铜脱落;
(5)精炼铜时,粗铜做阳极,精铜作阴极,CuSO4溶液作电解质溶液,电解过程中由于粗铜中有比铜活泼的杂质,铝和锌都先失电子进入溶液,而阴极析出的仍然是铜,所以精炼后电解质溶液中的阳离子有Al3+、Zn2+、Cu2+.
解答:
解:(1)由流程图转化可知,气体A中的大气污染物主要是二氧化硫,选择试剂吸收二氧化硫,不能产生新的污染气体,
a、浓H2SO4不能吸收二氧化硫,故a错误;
b、稀HNO3可以吸收二氧化硫,但生成NO污染大气,故b错误;
c、NaOH溶液与二氧化硫反应生成亚硫酸钠,故c正确;
d、氨水与二氧化硫反应生成亚硫酸铵,故d正确;
故答案为:cd;
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明含有Fe3+;Fe2+具有还原性,可以利用KMnO4溶液检验,取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去,根据Ksp[Fe(OH)3]=C(Fe3+)C(OH-)3,Fe3+的浓度=
=
=4.0×10-11mol/L,
故答案为:KSCN溶液;KMnO4溶液;4.0×10-11mol/L;
(3)由流程图转化可知,Cu2O与Al反应置换反应生成Al2O3与Cu,反应方程式为3Cu2O+2Al
Al2O3+6Cu,故答案为:3Cu2O+2Al
Al2O3+6Cu;
(4)a.精炼铜时,粗铜做阳极,精铜作阴极,CuSO4溶液作电解质溶液,电解过程中由于粗铜中有比铜活泼的杂质,所以当这些杂质溶解时,阴极析出的仍然是铜,所以CuSO4溶液的浓度变小;故a错误;
b.精炼铜时,粗铜做阳极,连接电源正极,发生氧化反应故b正确;
c.溶液中Cu2+向阴极移动,故c错误;
d.Ag、Pt、Au不如铜活泼,铜放电后Ag、Pt、Au从粗铜脱落,利用阳极泥可回收Ag、Pt、Au等金属,故d正确;
故答案为:bd;
(5)精炼铜时,粗铜做阳极,精铜作阴极,CuSO4溶液作电解质溶液,电解过程中由于粗铜中有比铜活泼的杂质,铝和锌都先失电子进入溶液,而阴极析出的仍然是铜,所以精炼后电解质溶液中的阳离子有Al3+、Zn2+、Cu2+,故答案:Al3+、Zn2+、Cu2+.
a、浓H2SO4不能吸收二氧化硫,故a错误;
b、稀HNO3可以吸收二氧化硫,但生成NO污染大气,故b错误;
c、NaOH溶液与二氧化硫反应生成亚硫酸钠,故c正确;
d、氨水与二氧化硫反应生成亚硫酸铵,故d正确;
故答案为:cd;
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明含有Fe3+;Fe2+具有还原性,可以利用KMnO4溶液检验,取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去,根据Ksp[Fe(OH)3]=C(Fe3+)C(OH-)3,Fe3+的浓度=
| Ksp[Fe(OH) 3] |
| C(OH -)3 |
| 4.0×10 - 38 |
| (10 -9) 3 |
故答案为:KSCN溶液;KMnO4溶液;4.0×10-11mol/L;
(3)由流程图转化可知,Cu2O与Al反应置换反应生成Al2O3与Cu,反应方程式为3Cu2O+2Al
| ||
| ||
(4)a.精炼铜时,粗铜做阳极,精铜作阴极,CuSO4溶液作电解质溶液,电解过程中由于粗铜中有比铜活泼的杂质,所以当这些杂质溶解时,阴极析出的仍然是铜,所以CuSO4溶液的浓度变小;故a错误;
b.精炼铜时,粗铜做阳极,连接电源正极,发生氧化反应故b正确;
c.溶液中Cu2+向阴极移动,故c错误;
d.Ag、Pt、Au不如铜活泼,铜放电后Ag、Pt、Au从粗铜脱落,利用阳极泥可回收Ag、Pt、Au等金属,故d正确;
故答案为:bd;
(5)精炼铜时,粗铜做阳极,精铜作阴极,CuSO4溶液作电解质溶液,电解过程中由于粗铜中有比铜活泼的杂质,铝和锌都先失电子进入溶液,而阴极析出的仍然是铜,所以精炼后电解质溶液中的阳离子有Al3+、Zn2+、Cu2+,故答案:Al3+、Zn2+、Cu2+.
点评:本题考查了元素化合物的性质、电化学知识、离子检验等知识点,难度较大,注意离子的检验是高考的热点,选取的试剂和检验离子反应后要有特殊现象,会运用知识迁移方法解决问题.

练习册系列答案
相关题目
下面有关晶体的叙述中,不正确的是( )
| A、金刚石为空间网状结构,由共价键形成的碳原子环上,最小的环上有6个碳原子 |
| B、氯化钠晶体中,每个Na+周围距离相等的Na+共有6个 |
| C、氯化铯晶体中,每个Cs+周围紧邻8个Cl- |
| D、干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
下列电离方程式正确的是( )
| A、NaHCO3═Na++H++CO32- |
| B、Ba(OH)2═Ba2++OH- |
| C、Al2(SO4)3═2Al3++3SO42- |
| D、H2SO4═H2++SO42- |
下列各组物质的无色溶液,不用其他试剂即可鉴别的是( )
①KOH Na2SO4 AlCl3
②NaHCO3 Ba(OH)2 H2SO4
③盐酸 Na[Al(OH)4]NaHSO4
④Ca(OH)2 Na2CO3 BaCl2.
①KOH Na2SO4 AlCl3
②NaHCO3 Ba(OH)2 H2SO4
③盐酸 Na[Al(OH)4]NaHSO4
④Ca(OH)2 Na2CO3 BaCl2.
| A、①② | B、②③ |
| C、①③④ | D、①②④ |
铜粉放入稀硫酸溶液中,加热后无明显现象发生.当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出.该盐是( )
| A、Fe2(SO4)3 |
| B、Na2CO3 |
| C、KNO3 |
| D、FeSO4 |
 乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
