题目内容
12.室温下,下列溶液中粒子浓度关系正确的是( )| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| C. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| D. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
分析 A.Na2S是强碱弱酸盐,硫离子两步水解都生成OH-,但其第一步水解程度远远大于第二步水解程度;
B.CO32-水解生成HCO3-,所以溶液中还存在HCO3-,任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
C.氯水中存在Cl2+H2O?H++Cl-+HClO、HClO?H++ClO-,且HClO电离程度较小;
D.任何电解质溶液中都存在物料守恒,根据物料守恒判断.
解答 解:A.Na2S是强碱弱酸盐,硫离子两步水解都生成OH-,但其第一步水解程度远远大于第二步水解程度,所以离子浓度大小顺序是c(Na+)>c(OH-)>c(HS-)>c(H2S),故A错误;
B.CO32-水解生成HCO3-,所以溶液中还存在HCO3-,任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-),故B错误;
C.氯水中存在Cl2+H2O?H++Cl-+HClO、HClO?H++ClO-,HClO电离程度大于水的电离程度,但HClO电离程度较小,HCl、HClO都电离生成氢离子,离子浓度大小顺序是c(H+)>c(Cl-)>c(ClO-)>c(OH-),故C错误;
D.任何电解质溶液中都存在物料守恒,根据物料守恒得c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)=2c(Na+),故D正确;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查学生分析判断能力,把握溶液中溶质及其性质是解本题关键,注意C中存在的两个电离平衡,为易错点.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
3.下列说法中正确的是( )
| A. | 碱性氧化物均为金属氧化物 | |
| B. | 一种元素可能有多种氧化物,但是同种化合价只对应一种氧化物 | |
| C. | 酸根离子中不可能含有金属元素 | |
| D. | 还原产物只有还原性,氧化产物只有氧化性 |
7. 乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
①部分物质的沸点:
②乳酸乙酯易溶于苯、乙醇;
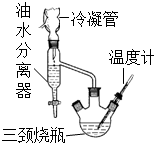
③水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发.该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下:
第一步:在三颈烧瓶中加入0.1mol无水乳酸、过量的65.0mL无水乙醇、一定量的苯、沸石…;装上油水分离器和冷凝管,缓慢加热回流至反应完全.
第二步:将三颈烧瓶中液体倒入盛有过量某试剂的烧杯中,搅拌并分出有机相后,再用水洗.
第三步:将无水CaCl2加入到水洗后的产品中,过滤、蒸馏.
(1)第一步操作中,还缺少的试剂是浓硫酸;加入苯的目的是形成水、乙醇、苯共沸物,分离反应生成的水,促进酯化反应正向进行;实验过程中,酯化反应进行完全的标志是油水分离器中液体不再增加.
(2)第二步中证明“水洗”已经完成的实验方案是测定水洗液的pH至7.
(3)利用核磁共振氢谱可以鉴定制备的产物是否为乳酸乙酯,乳酸乙酯分子核磁共振氢谱中有5个峰.
 乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:①部分物质的沸点:
| 物质 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
| 沸点/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
③水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发.该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下:
第一步:在三颈烧瓶中加入0.1mol无水乳酸、过量的65.0mL无水乙醇、一定量的苯、沸石…;装上油水分离器和冷凝管,缓慢加热回流至反应完全.
第二步:将三颈烧瓶中液体倒入盛有过量某试剂的烧杯中,搅拌并分出有机相后,再用水洗.
第三步:将无水CaCl2加入到水洗后的产品中,过滤、蒸馏.
(1)第一步操作中,还缺少的试剂是浓硫酸;加入苯的目的是形成水、乙醇、苯共沸物,分离反应生成的水,促进酯化反应正向进行;实验过程中,酯化反应进行完全的标志是油水分离器中液体不再增加.
(2)第二步中证明“水洗”已经完成的实验方案是测定水洗液的pH至7.
(3)利用核磁共振氢谱可以鉴定制备的产物是否为乳酸乙酯,乳酸乙酯分子核磁共振氢谱中有5个峰.
4.要除去石英沙中的少量杂质碳酸钙,可采用的方法是( )
| A. | 用水溶解后过滤分离 | B. | 用稀盐酸溶解过滤分离 | ||
| C. | 用稀硫酸溶解过滤分离 | D. | 用酒精灯加热 |
1.X、Y、Z、W、J是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是146C.
(2)元素Y位于元素周期表第三周期第VI族.
(3)元素Z的原子最外层共有17种不同运动状态的电子.
(4)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.W的基态原子核外价电子排布图是 .
.
(5)元素Y与元素Z相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是cdf.
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
(6)Y、Z两元素的最高价氧化物对应的水化物的酸性强弱为HClO4>H2SO4(用化学式表示).比较下列物质的酸性强弱:HZO<HZO3<HZO4.
(7)J的气态氢化物中心原子的杂化方式是sp3,与该原子形成的单质分子互为等电子体的常见分子的分子式为CO.
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
(2)元素Y位于元素周期表第三周期第VI族.
(3)元素Z的原子最外层共有17种不同运动状态的电子.
(4)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.W的基态原子核外价电子排布图是
 .
.(5)元素Y与元素Z相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是cdf.
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
(6)Y、Z两元素的最高价氧化物对应的水化物的酸性强弱为HClO4>H2SO4(用化学式表示).比较下列物质的酸性强弱:HZO<HZO3<HZO4.
(7)J的气态氢化物中心原子的杂化方式是sp3,与该原子形成的单质分子互为等电子体的常见分子的分子式为CO.
2.小明做实验时不小心沾了一些KMnO4,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+H2C2O4+H+→CO2↑+Mn2++□(未配平).关于此反应的叙述正确的是( )
| A. | 该反应的氧化剂是H2C2O4 | B. | 1molMnO4-在反应中失去5mol电子 | ||
| C. | 从反应中看出草酸性质很不稳定 | D. | 配平该反应后,H+的计量数是6 |
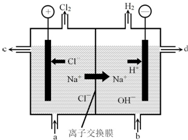 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.