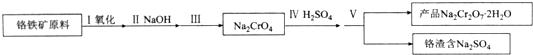
题目内容
19.在0.1mol•L-1 NH3•H2O溶液中存在如下电离平衡:NH3•H2O?NH4++OH-.对于该平衡,下列叙述中正确的是( )| A. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 降低温度,溶液中c(NH4+)增大 | |
| C. | 加入少量NaOH固体,平衡向左移动,电离平衡常数减小 | |
| D. | 加入少量0.1 mol•L-1 盐酸,溶液中c(OH-)增大 |
分析 弱电解质的电离是吸热反应,降低温度抑制弱电解质电离,向氨水中加入酸促进一水合氨电离,加入碱抑制一水合氨电离,加水稀释促进一水合氨电离,注意电离平衡常数只与温度有关.
解答 解:A.加水稀释时,促进一水合氨电离,氢氧根 离子的物质的量增大,一水合氨的物质的量减小,所以溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大,故A正确;
B.一水合氨的电离是吸热反应,降低温度抑制其电离,则溶液中c(NH4+)减小,故B错误;
C.向氨水中加入少量氢氧化钠,溶液中氢氧根离子浓度增大,则抑制一水合氨电离,温度不变,电离平衡常数不变,故C错误;
D.向氨水中加入少量盐酸,氢离子和氢氧根离子反应生成水,所以溶液中c(OH-)减小,故D错误;
故选A.
点评 本题考查了弱电解质的电离,明确影响弱电解质电离的因素,题目难度不大,注意加水稀释氨水溶液,溶液中氢离子浓度增大,为易错点.

练习册系列答案
相关题目
9.下列实验设计和结论相符的是( )
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定呈碱性 | |
| C. | 某无色溶液中加入BaCl2溶液,再加稀盐酸,沉淀不溶解,原溶液中一定有SO42- | |
| D. | 某无色溶液中加入酚酞试液变红,该溶液一定是碱溶液 |
10.下列离子方程式正确的为( )
| A. | 少量NaHCO3与过量Ca(OH)2反应:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| B. | 在CuSO4溶液中加Ba(OH)2溶液 SO42-+Ba2+═BaSO4↓ | |
| C. | Na2S溶液中通入H2S气体 S2-+H+═HS- | |
| D. | NaHCO3溶液与KHSO4溶液反应 HCO3-+H+═CO2↑+H2O |
7. 乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
①部分物质的沸点:
②乳酸乙酯易溶于苯、乙醇;
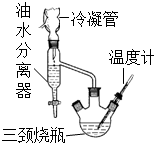
③水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发.该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下:
第一步:在三颈烧瓶中加入0.1mol无水乳酸、过量的65.0mL无水乙醇、一定量的苯、沸石…;装上油水分离器和冷凝管,缓慢加热回流至反应完全.
第二步:将三颈烧瓶中液体倒入盛有过量某试剂的烧杯中,搅拌并分出有机相后,再用水洗.
第三步:将无水CaCl2加入到水洗后的产品中,过滤、蒸馏.
(1)第一步操作中,还缺少的试剂是浓硫酸;加入苯的目的是形成水、乙醇、苯共沸物,分离反应生成的水,促进酯化反应正向进行;实验过程中,酯化反应进行完全的标志是油水分离器中液体不再增加.
(2)第二步中证明“水洗”已经完成的实验方案是测定水洗液的pH至7.
(3)利用核磁共振氢谱可以鉴定制备的产物是否为乳酸乙酯,乳酸乙酯分子核磁共振氢谱中有5个峰.
 乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:①部分物质的沸点:
| 物质 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
| 沸点/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
③水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发.该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下:
第一步:在三颈烧瓶中加入0.1mol无水乳酸、过量的65.0mL无水乙醇、一定量的苯、沸石…;装上油水分离器和冷凝管,缓慢加热回流至反应完全.
第二步:将三颈烧瓶中液体倒入盛有过量某试剂的烧杯中,搅拌并分出有机相后,再用水洗.
第三步:将无水CaCl2加入到水洗后的产品中,过滤、蒸馏.
(1)第一步操作中,还缺少的试剂是浓硫酸;加入苯的目的是形成水、乙醇、苯共沸物,分离反应生成的水,促进酯化反应正向进行;实验过程中,酯化反应进行完全的标志是油水分离器中液体不再增加.
(2)第二步中证明“水洗”已经完成的实验方案是测定水洗液的pH至7.
(3)利用核磁共振氢谱可以鉴定制备的产物是否为乳酸乙酯,乳酸乙酯分子核磁共振氢谱中有5个峰.
14.阿伏加德罗曾做过这样一个实验:“一抽真空的密闭容器重M g,在标准状况下,盛满以相同物质的量混合的NO和H2的混合气体后,称量为(M+Q)g.把混合气体排尽,再充满SO2气体,为使天平平衡,应在托盘天平的_边托盘上放置_ g砝码…”横线上分别应填的是( )
| A. | 右 (M+2Q) | B. | 左 (M+2Q) | C. | 右 (M+4Q) | D. | 左 (M+4Q) |
4.要除去石英沙中的少量杂质碳酸钙,可采用的方法是( )
| A. | 用水溶解后过滤分离 | B. | 用稀盐酸溶解过滤分离 | ||
| C. | 用稀硫酸溶解过滤分离 | D. | 用酒精灯加热 |
9.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+2c(RO32-) | |
| B. | 等体积等物质的量浓度的NaCl和NaClO溶液中离子总数:N前<N后 | |
| C. | 1mol/L的(NH4)2Fe(SO4)2•6H2O溶液中:c(NH4+)=c(SO42-)>c(Fe2+)>c(H+) | |
| D. | 0.1mol/LNaHX溶液pH=3,则此溶液中有:c(HX-)>c(H2X)>c(X2-) |