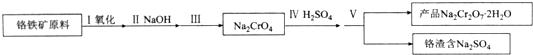
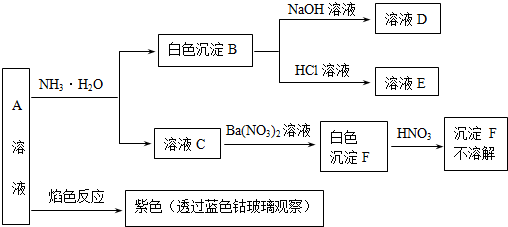
题目内容
16.800℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2):| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=$\frac{0.40}{t_1}$mol/(L•min) | |
| B. | 保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| D. | 温度升至1000℃,上述反应平衡常数为1.6,则正反应为放热反应 |
分析 A.根据v=$\frac{△c}{△t}$计算v(CO),结合化学反应速率之比等于化学计量数之比计算v(H2);
B.CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O到达平衡时对应生成物的浓度、物质的量相同;
C.保持其他条件不变,增加一种反应物的浓度,平衡向正反应方向移动,另一种反应物的转化率增大;
D.根据平衡时各物质的浓度计算700℃时的平衡常数,比较不同温度下的平衡常数大小可判断反应的吸放热.
解答 解:A.v(CO)=$\frac{\frac{0.4mol}{2L}}{{t}_{1}min}$=$\frac{0.2}{{t}_{1}}$mol/(L•min),化学反应速率之比等于化学计量数之比,则v(H2)=v(CO)=$\frac{0.2}{{t}_{1}}$mol/(L•min),故A错误;
B.CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O,平衡时生成物的浓度对应相同,t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,根据化学方程式可知,则生成的n(CO2)=0.4mol,故B正确;
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大,故C错误;
D.t1min时反应已经达到平衡状态,此时c(CO)=$\frac{0.8mol}{2L}$=0.4mol/L,c(H2O)=$\frac{0.2mol}{2L}$=0.1mol/L,c(CO2)=c(H2)=$\frac{0.4mol}{2L}$=0.2mol/L,则k=$\frac{0.2×0.2}{0.4×0.1}$=1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动的,那么正反应应为放热反应,故D错误;
故选B.
点评 本题属于化学平衡问题,题目难度中等,主要考查学生对速率概念与计算,平衡常数概念与计算,平衡移动等有关内容理解和掌握程度,注意C选项中的规律利用,试题培养了学生的分析能力及化学计算能力.

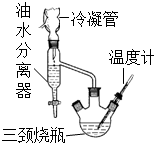 乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:①部分物质的沸点:
| 物质 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
| 沸点/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
③水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发.该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下:
第一步:在三颈烧瓶中加入0.1mol无水乳酸、过量的65.0mL无水乙醇、一定量的苯、沸石…;装上油水分离器和冷凝管,缓慢加热回流至反应完全.
第二步:将三颈烧瓶中液体倒入盛有过量某试剂的烧杯中,搅拌并分出有机相后,再用水洗.
第三步:将无水CaCl2加入到水洗后的产品中,过滤、蒸馏.
(1)第一步操作中,还缺少的试剂是浓硫酸;加入苯的目的是形成水、乙醇、苯共沸物,分离反应生成的水,促进酯化反应正向进行;实验过程中,酯化反应进行完全的标志是油水分离器中液体不再增加.
(2)第二步中证明“水洗”已经完成的实验方案是测定水洗液的pH至7.
(3)利用核磁共振氢谱可以鉴定制备的产物是否为乳酸乙酯,乳酸乙酯分子核磁共振氢谱中有5个峰.
| A. | 用水溶解后过滤分离 | B. | 用稀盐酸溶解过滤分离 | ||
| C. | 用稀硫酸溶解过滤分离 | D. | 用酒精灯加热 |
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
(2)元素Y位于元素周期表第三周期第VI族.
(3)元素Z的原子最外层共有17种不同运动状态的电子.
(4)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.W的基态原子核外价电子排布图是
 .
.(5)元素Y与元素Z相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是cdf.
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
(6)Y、Z两元素的最高价氧化物对应的水化物的酸性强弱为HClO4>H2SO4(用化学式表示).比较下列物质的酸性强弱:HZO<HZO3<HZO4.
(7)J的气态氢化物中心原子的杂化方式是sp3,与该原子形成的单质分子互为等电子体的常见分子的分子式为CO.
| A. | 55 kJ | B. | 220 kJ | C. | 550 kJ | D. | 1 108 kJ |