题目内容
1.氮的化合物是重要的化工原料,在工农业生产中有很多重要应用.工业上合成氮及联合制碱法的流程示意图如下: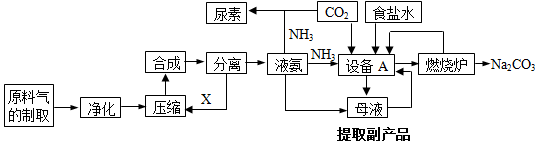
(1)在工业生产中,设备A的名称为沉淀池,A中发生的化学反应方程式是NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓.
(2)在上述生产中向母液通入氨气同时加入NaCl,可促进副产品氯化铵的析出.
(3)原料气中往往含有H2S、CO、CO2等杂质,必须除去这些杂质的目的是防止催化剂中毒.
(4)某实验小组,利用下列装置图模拟“联合制碱法”的第一步反应.
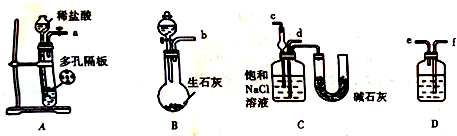
上述装置中接口连接顺序为D;D中应选用的液体为饱和NaHCO3溶液.
A.a接c;b接f;e接d
B.a接d;b接f;e接c
C.b接d;a接c;f接 e
D.b接c;a接f;e接d
(5)某工厂用氨制硝酸,再进一步制NH4NO3.已知由NH3制HNO3时产率为88%,由NH3被HNO3的吸收率为98%.则该工厂用100吨氨最多能制硝酸铵218吨.
分析 (1)氨气、氯化钠溶液、二氧化碳在沉淀池中反应生成碳酸氢钠和氯化铵;
(2)含有碳酸氢钠和氯化铵的混合物经过过滤,分离出碳酸氢钠晶体,剩余的母液中含有氯化铵;
(3)H2S、CO、CO2等杂质容易造成催化剂中毒,降低催化效果,需要将原料气中的杂质除去;
(4)根据装置A制取CO2,装置B制取NH3,装置D除去二氧化碳中的HCl,二氧化碳与氨气通入C中应防止倒吸,据此分析连接仪器装置;
(5)设出制备出的硝酸铵的物质的量为xmol,然后根据在反应过程中的损耗,将NH4NO3时所需的NH3的物质的量和制备HNO3时所需的NH3的分别表示出,质量共为100t,据此进行求算.
解答 解:(1)氨气、氯化钠溶液、二氧化碳在沉淀池中反应生成碳酸氢钠和氯化铵,所以设备A为沉淀池,发生的反应为NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓;
故答案为:NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓;
(2)含有碳酸氢钠和氯化铵的混合物经过过滤,分离出碳酸氢钠晶体,剩余的母液中含有氯化铵,母液通入氨气同时加入NaCl,可促进副产品氯化铵的析出;
故答案为:NaCl;
(3)原料气中的H2S、CO、CO2等杂质容易造成催化剂中毒,降低催化效果,所以必须将原料气中往往含有的H2S、CO、CO2等杂质除去,防止催化剂中毒;
故答案为:防止催化剂中毒;
(4)足量的CO2与NaOH反应生成NaHCO3,装置A产生CO2,装置B生石灰与浓氨水产生NH3,装置D除去二氧化碳中的HCl,二氧化碳与氨气通入C中应防止倒吸,则b接c,故a接f、e接d;由于二氧化碳在碳酸氢钠饱和溶液中溶解度较小,而HCl能被碳酸氢钠吸收,所以D中液体为饱和NaHCO3溶液;
故答案为:D;饱和NaHCO3溶液;
(5)设制备出的NH4NO3的物质的量为xmol,
根据反应NH3+HNO3=NH4NO3可知:NH3~NH4NO3,由于NH3被HNO3的吸收率为98%,故在此反应中所需的NH3的物质的量为:$\frac{x}{98%}$=1.02xmol;
同时据反应可知:NH3~HNO3~NH4NO3,而由NH3制HNO3时产率为88%,故生成xmolNH4NO3,需要的制备硝酸的NH3的物质的量为:$\frac{x}{88%}$=1.136xmol,
即制得xmolNH4NO3所需的氨气的物质的量为:(1.02x+1.136x)mol,
根据氨气的质量为100t即108g可得:(1.02x+1.136x)mol×17g/mol=108g,
解得:x=2728364.07mol,
NH4NO3的质量为:m=nM=2728364.07mol×80g/mol≈218t,
故答案为:218.
点评 本题考查了合成氨、制碱法的工艺的流程,题目难度中等,明确制备流程及反应原理为解答关键,注意根据物质的主要性质分析工艺装置、反应原理,试题充分考查了学生的分析、理解能力及化学实验能力.

| A. | 阿司匹林 | B. | 青霉素 | C. | 麻黄素 | D. | 胃舒平 |
| A. | 1 mol KClO3 | B. | 49g H3PO4 | ||
| C. | 标准状况下5.6L氧气 | D. | 3.01×1023个CO2 |
①2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑
②Si+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4
③SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl
下列有关说法不正确的是( )
| A. | ②是化合反应 | B. | ①②③是氧化还原反应 | ||
| C. | ①③是置换反应 | D. | ①③是复分解反应 |
| A. | 1molH2O所含有的原子数为NA | |
| B. | 32gO2含有的氧原子数为2NA | |
| C. | 常温常压下,11.2 LCl2 所含的分子数为0.5NA | |
| D. | 1L0.1mol/LNaCl溶液中所含的Na+数为NA |
| A. | H+(aq)+OH-(aq)=H2O(l)△H=-a kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,出热量为a kJ | |
| B. | 因CuSO4•5H2O(s)=CuSO4(s)+5H2O(l)△H=+b kJ/mol,故1 mol CuSO4(s)溶于水时,放出热量b kJ | |
| C. | 因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+c kJ/mol | |
| D. | 因N2(g)+3H2(g)?2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ |
| A. | 着色剂 | B. | 防腐剂 | C. | 调味剂 | D. | 营强化剂g |