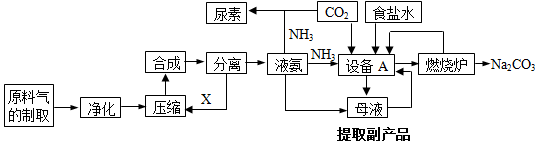
题目内容
10.酱油是一种常用的食品添加剂,它属于食品添加剂中的( )| A. | 着色剂 | B. | 防腐剂 | C. | 调味剂 | D. | 营强化剂g |
分析 酱油是一种常用的食品添加剂,属于着色剂.
解答 解:酱油是一种常用的食品添加剂,它属于食品添加剂中的着色剂,故选A.
点评 本题考查常见食品添加剂的判断,该题是常识性知识的考查,难度不大,学生只要记住即可,也有了培养学生的应试能力和学习效率.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
7.下列各粒子半径依次增加的是( )
| A. | Cs+、K+、Mg2+、Al3+ | B. | F、F-、Cl-、Br- | ||
| C. | Ca2+、K+、S2-、Cl- | D. | Al、Al3+、Mg、K |
15. 某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
A.移取20.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至0刻度以上 2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成下列问题:
(1)正确操作步骤的顺序是B、D、C、E、A、F(填字母序号).
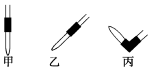
(2)如图,排除碱式滴定管中气泡的方法应采用操作丙(填图编号),轻轻挤压玻璃球使尖嘴部分充满碱液.
(3)上述B步骤操作的目的是防止滴定管内壁附着的水将标准溶液稀释而带来误差.
(4)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果偏高(填“偏高”、“偏低”或“不变”).
(5)判断到达滴定终点的实验现象是滴入最后一滴KOH溶液,溶液由无色变为浅红色,且在半分钟内不褪色.
(6)重复上述滴定2~3次,记录数据如表:
根据表中数据,可计算出该盐酸的浓度约为0.09mol/L(保留两位小数).
 某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:A.移取20.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至0刻度以上 2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成下列问题:
(1)正确操作步骤的顺序是B、D、C、E、A、F(填字母序号).
(2)如图,排除碱式滴定管中气泡的方法应采用操作丙(填图编号),轻轻挤压玻璃球使尖嘴部分充满碱液.
(3)上述B步骤操作的目的是防止滴定管内壁附着的水将标准溶液稀释而带来误差.
(4)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果偏高(填“偏高”、“偏低”或“不变”).
(5)判断到达滴定终点的实验现象是滴入最后一滴KOH溶液,溶液由无色变为浅红色,且在半分钟内不褪色.
(6)重复上述滴定2~3次,记录数据如表:
| 实验 编号 | KOH溶液的浓度(mol•L-1) | 滴定完成时,滴入KOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
2.下列实验操作所用仪器合理的是( )
| A. | 把烧杯内的溶液转移到容量瓶中时,必须用玻璃棒引流 | |
| B. | 用100mL量筒量取95.20 mL盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用500mL容量瓶配制50mL0.10mol/L溶液 |
19.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,48gO3含有的氧原子数为3NA | |
| B. | 1 mol OH-所含的电子数为9NA | |
| C. | 常温常压下,11.2 L氧气所含的原子数为NA | |
| D. | 物质的量浓度为1mol/L MgCl2溶液,含有Cl-离子数为2NA |
20.可逆反应A(g)+3B(g)?2C(g)△H=-QkJ/mol.有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2molC达到平衡后吸收热量为Q2 kJ;已知Q1=3Q2.下列叙述正确的是( )
| A. | 乙中C的转化率为75% | |
| B. | 反应.达到平衡前,甲中始终有V正>V逆,乙中始终有V正<V逆 | |
| C. | 在该条件下,反应2C(g)?A(g)+3B(g)的平衡常数为2.7×1.54 | |
| D. | 乙中的热化学方程式为2C(g))?A(g)+3B(g)△H=+Q2kJ/mol |