题目内容
2.下列叙述不正确的是( )| A. | 4.6 gNa与O2完全反应,生成7g产物时失去电子的物质的量为0.2 mol | |
| B. | Na与稀硫酸反应的离子方程式为2Na+2H+=2Na++H2↑ | |
| C. | 将少量Na投入到CuSO4溶液中,既有沉淀生成又有气体放出 | |
| D. | 金属钠着火可以用泡沫灭火器或用干燥的沙土灭火 |
分析 A、依据质量换算物质的量,结合钠与氧气反应时钠与电子的关系来解答;
B、Na与稀硫酸实际与酸电离出的氢离子反应;
C、钠和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀;
D、钠与氧气反应 生成过氧化钠,过氧化钠可与二氧化碳反应生成碳酸钠和氧气.
解答 解:A、4.6gNa的物质的为0.2mol,钠与氧气反应时1个钠转移1个电子,所以失去电子的物质的量为0.2 mol,故A正确;
B、Na与稀硫酸实际与酸电离出的氢离子反应,所以反应的离子方程式为2Na+2H+=2Na++H2↑,故B正确;
C、钠和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀,将少量Na投入到CuS04溶液中,既有沉淀生成又有气体放出,故C正确;
D、钠与氧气反应 生成过氧化钠,过氧化钠可与二氧化碳反应生成碳酸钠和氧气,则钠失火时不能用泡沫灭火器灭火,故D错误.
故选D.
点评 本题考查物质性质的分析应用,反应条件和原理的判断,金属钠性质的分析应用是解题关键,题目较简单.

练习册系列答案
相关题目
13.在一定温度下,反应 H2(g)+I2(g)?2HI(g)达到平衡的标志是( )
| A. | 单位时间内生成1 mol的H2,同时生成2 mol 的HI | |
| B. | 容器内的总压强不随时间的变化而变化 | |
| C. | 1mol I-I 键断裂的同时有2mol HI键形成 | |
| D. | 容器内气体颜色不再变化 |
10.下列反应能用离子方程式OH-+HCO3-→CO32-+H2O表示的是( )
| A. | NaOH+NaHCO3→Na2CO3+H2O | |
| B. | Ca(OH)2+Ca(HCO3)2→2CaCO3↓+2H2O | |
| C. | 2NaOH+NH4HCO3→NH3?H2O+Na2CO3+H2O | |
| D. | NaOH+Ca(HCO3)2→2CaCO3↓+H2O+NaHCO3 |
14.下列有关性质的比较,用元素周期律解释不合理的是( )
| A. | 酸性:H2SO4<H3PO4 | B. | 非金属性:Cl>Br | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 稳定性:HF>HCl |
11.下列离子方程式书写正确的是( )
| A. | Na2O2 与H2O反应制备O2 :2Na2O2 +2H2O═4Na++4OH-+O2↑ | |
| B. | Cl2通入石灰乳中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 氢氧化钠溶液腐蚀玻璃:2OH-+SiO2═SiO32-+H2O |
12.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,22.4L H2中所含质子数、中子数均为2NA | |
| B. | 32g O2气体和32g O3气体的分子数之比为3:2 | |
| C. | 1L 1mol•L-1的盐酸中所含粒子总数为2NA | |
| D. | 71g氯气与足量铁粉充分反应,转移的电子数为3NA |
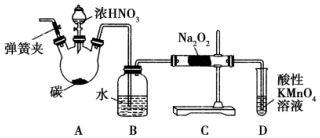 亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.