题目内容
12.设NA为阿伏加德罗常数,下列叙述中正确的是( )| A. | 标准状况下,22.4L H2中所含质子数、中子数均为2NA | |
| B. | 32g O2气体和32g O3气体的分子数之比为3:2 | |
| C. | 1L 1mol•L-1的盐酸中所含粒子总数为2NA | |
| D. | 71g氯气与足量铁粉充分反应,转移的电子数为3NA |
分析 A.H2不含中子;
B.依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算解答;
C.粒子种类指代不明确;
D.氯气与铁反应生成氯化铁,氯气不足,依据氯气的物质的量计算转移电子数目.
解答 解:A.H2不含中子,故A错误;
B.依据n=$\frac{N}{N{\;}_{A}}$可知分子数之比等于物质的量之比,32g O2气体和32g O3气体的物质的量之比为:$\frac{32g}{32g/mol}$:$\frac{32g}{48g/mol}$=3:2,故B正确;
C.使用物质的量应指明微粒的种类,故C错误;
D.71g氯气的物质的量为1mol,而氯气反应后变为-1价,故1mol氯气转移2mol电子即2NA个,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,注意物质的量使用注意事项,题目难度不大.

练习册系列答案
相关题目
2.下列叙述不正确的是( )
| A. | 4.6 gNa与O2完全反应,生成7g产物时失去电子的物质的量为0.2 mol | |
| B. | Na与稀硫酸反应的离子方程式为2Na+2H+=2Na++H2↑ | |
| C. | 将少量Na投入到CuSO4溶液中,既有沉淀生成又有气体放出 | |
| D. | 金属钠着火可以用泡沫灭火器或用干燥的沙土灭火 |
3.最早总结出元素周期律,画出元素周期表的科学家是( )
| A. | 道尔顿 | B. | 阿伏加德罗 | C. | 门捷列夫 | D. | 普里斯特利 |
7.下列离子方程式书写正确的是( )
| A. | 向FeCl2溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | Ba(OH)2溶液与硫酸反应:OH-+H+═H2O | |
| C. | 次氯酸钙溶液中通入少量SO2:2ClO-+Ca2++SO2+H2O═CaSO3↓+2HClO | |
| D. | 碳酸氢钠溶液中加入过量石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O |
2.下列物质中,长久露置于空气中会发生颜色变化的是( )
①绿矾 ②氢氧化铁 ③氯水 ④亚硫酸钠 ⑤过氧化钠.
①绿矾 ②氢氧化铁 ③氯水 ④亚硫酸钠 ⑤过氧化钠.
| A. | 全部 | B. | ②③④ | C. | ①②③ | D. | ①②③⑤ |
6.已知反应: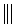 +
+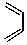 $\stackrel{△}{→}$
$\stackrel{△}{→}$ 如果要合成化合物A,其结构为:
如果要合成化合物A,其结构为: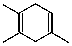 下列说法不正确的是( )
下列说法不正确的是( )
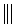 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$ 如果要合成化合物A,其结构为:
如果要合成化合物A,其结构为: 下列说法不正确的是( )
下列说法不正确的是( )| A. | 化合物A和HBr 按照物质的量1:1加成时,有三种不同的产物 | |
| B. | 该反应的原理是加成反应 | |
| C. | 合成A的原料可能是:丙炔和2,3-二甲基-1,3-丁二烯 | |
| D. | 合成A的原料可能是:2-丁炔和2-甲基-1,3-丁二烯 |
7.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体 | |
| D. | 除去乙酸乙酯中的乙酸,先加入饱和Na2CO3溶液再分液 |
 .它位于元素周期表的第三周期,第ⅢA族.
.它位于元素周期表的第三周期,第ⅢA族.