题目内容
13.在一定温度下,反应 H2(g)+I2(g)?2HI(g)达到平衡的标志是( )| A. | 单位时间内生成1 mol的H2,同时生成2 mol 的HI | |
| B. | 容器内的总压强不随时间的变化而变化 | |
| C. | 1mol I-I 键断裂的同时有2mol HI键形成 | |
| D. | 容器内气体颜色不再变化 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、单位时间内生成1 mol的H2等效于消耗2 mol 的HI的同时生成2 mol 的HI,正逆反应速率相等,故A正确;
B、两边计量数相等,所以容器内的总压强始终不随时间的变化而变化,故B错误;
C、1mol I-I 键断裂的同时有2mol HI键形成,都体现正反应的方向,故C错误;
D、容器内气体颜色不再变化,说明碘蒸气的浓度不变,反应达平衡状态,故D正确;
故选AD.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
4.4FeS2+11O2=2Fe2O3+8SO2(已知FeS2中Fe为+2价)的反应中被氧化的元素是( )
①Fe(+2)②Fe(+3)③S(-1)④O(0)⑤S(+4)
①Fe(+2)②Fe(+3)③S(-1)④O(0)⑤S(+4)
| A. | ①和③ | B. | 只有④ | C. | 只有③ | D. | 只有① |
8.钢铁发生电化腐蚀时,负极上发生的反应是( )
| A. | 2H++2e-═H2↑ | B. | 2H2O+O2+4e-═4OH- | ||
| C. | Fe-2e-═Fe2+ | D. | 4OH--4e-═O2↑+2H2O |
18.合金在生活中有广泛应用.下列物质不属于合金的是( )
| A. | 硬铝 | B. | 青铜 | C. | 不锈钢 | D. | 水银 |
2.下列叙述不正确的是( )
| A. | 4.6 gNa与O2完全反应,生成7g产物时失去电子的物质的量为0.2 mol | |
| B. | Na与稀硫酸反应的离子方程式为2Na+2H+=2Na++H2↑ | |
| C. | 将少量Na投入到CuSO4溶液中,既有沉淀生成又有气体放出 | |
| D. | 金属钠着火可以用泡沫灭火器或用干燥的沙土灭火 |
3.最早总结出元素周期律,画出元素周期表的科学家是( )
| A. | 道尔顿 | B. | 阿伏加德罗 | C. | 门捷列夫 | D. | 普里斯特利 |
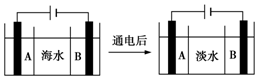 水是一种重要的自然资源,是人类赖以生存不可或缺的物质,水质优劣直接影响人体健康.海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.
水是一种重要的自然资源,是人类赖以生存不可或缺的物质,水质优劣直接影响人体健康.海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.